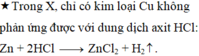Cho 17,6 gam hỗn hợp Fe, Cu tác dụng với dung dịch HCI dư, sau phản ứng thu được 4,48 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là

Những câu hỏi liên quan
Cho 10 gam hỗn hợp Mg và Cu tác dụng với dung dịch HCl dư. Sau khi phản ứng kết thúc thì thu được 4,48 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp ban đầu là bao nhiêu?
ta có Cu không tác dụng với HCl nên lượng khí thoát ra là của Mg
pthh Mg + 2HCl => MgCl2 + H2
nH2 = 4.48 / 22,4 =0,2 mol mà nMg = nH2 =0,2
=> mMg= 0,2 * 24 =4,8g
mCu = 10 - 4,8 =5,2 g
Đúng 1
Bình luận (0)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
Theo PTHH: \(n_{H_2}=n_{Mg}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,2\cdot24=4,8\left(g\right)\)
\(\Rightarrow m_{Cu}=10-4,8=5,2\left(g\right)\)
Đúng 2
Bình luận (0)
Bài 3. Cho 17,6 gam hỗn hợp Fe và Cu phản ứng với lượng dư dung dịch HCl loãng, sau phản ứng thu được 4,48 lít khí (đktc) a. Tính %m mỗi chất trong hỗn hợp ban đầu. b. Dẫn khí H2 thu được ở trên đi qua bột Fe2O3 nung nóng, tính khối lượng Fe tối đa có thể thu được
a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Đúng 1
Bình luận (0)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Cho 17,6 gam hỗn hợp Fe và Cu phản ứng với lượng dư dung dịch HCl loãng, sau phản ứng thu được 4,48 lít khí (đktc)
a. Tính %m mỗi chất trong hỗn hợp ban đầu.
b. Dẫn khí H2 thu được ở trên đi qua bột Fe2O3 nung nóng, tính khối lượng Fe tối đa có thể thu được?
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe .MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Hỗn hợp X gồm Zn, Fe, Cu. Cho 18,5 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được 4,48 lít H2 (đktc). Mặt khác cho 0,15 mol hỗn hợp X phản ứng vừa đủ với 3,92 lít khí Cl2 (đktc). Số mol Fe trong 18,5 gam hỗn hợp X là A. 0,1 mol B. 0,08 mol C. 0,12 mol D. 0,15 mol
Đọc tiếp
Hỗn hợp X gồm Zn, Fe, Cu. Cho 18,5 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được 4,48 lít H2 (đktc). Mặt khác cho 0,15 mol hỗn hợp X phản ứng vừa đủ với 3,92 lít khí Cl2 (đktc). Số mol Fe trong 18,5 gam hỗn hợp X là
A. 0,1 mol
B. 0,08 mol
C. 0,12 mol
D. 0,15 mol
1.cho 17,6g hỗn hợp A gồm Fe và Cu tác dụng với dung dịch h2so4 dư sau phản ứng thu được 4,48 lít khí h2 ( đktc)a. Tính khối lượng của từng kim loại trong hỗn hợp ban đầu b. Tính phần trăm khối lượng của từng kim loại trong hỗn hợp ban đầuc. Nếu cho hỗn kim loại trên vào dung dịch h2so4 đặc dư nóng thu được khí so2( đktc) tính khối lượng muối tạo thành 2. hòa tan hoàn toàn 27,6g hỗn hợp gồm Fe Fe2o3 Fe3o4 vào lượng dư dung dịch h2so4 98% ( đun nóng) sau phản ứng thu được dung dịch X và 5,04 lít...
Đọc tiếp
1.cho 17,6g hỗn hợp A gồm Fe và Cu tác dụng với dung dịch h2so4 dư sau phản ứng thu được 4,48 lít khí h2 ( đktc)
a. Tính khối lượng của từng kim loại trong hỗn hợp ban đầu
b. Tính phần trăm khối lượng của từng kim loại trong hỗn hợp ban đầu
c. Nếu cho hỗn kim loại trên vào dung dịch h2so4 đặc dư nóng thu được khí so2( đktc) tính khối lượng muối tạo thành
2. hòa tan hoàn toàn 27,6g hỗn hợp gồm Fe Fe2o3 Fe3o4 vào lượng dư dung dịch h2so4 98% ( đun nóng) sau phản ứng thu được dung dịch X và 5,04 lít khí so2 ( sản phẩm khử duy nhất, đo ở đktc ) tính khối lượng muối tan có trong dung dịch X
mong mọi người giúp vs ạ
Bài 1:
a+b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{11,2}{17,6}\cdot100\%\approx63,64\%\\\%m_{Cu}=36,36\%\end{matrix}\right.\)
c) Ta có: \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)=n_{CuSO_4}\)
\(\Rightarrow m_{muối}=0,1\cdot400+0,1\cdot160=56\left(g\right)\)
Đúng 1
Bình luận (0)
Bài 2:
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=27,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,39\\b=0,36\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,195\left(mol\right)\) \(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,195\cdot400=78\left(g\right)\)
Đúng 1
Bình luận (0)
Hỗn hợp X gồm Zn, Fe, Cu. Cho 18,5 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được 4,48 lit H2 (đktc). Mặt khác cho 0,15 mol hỗn hợp X phản ứng vừa đủ với 3,92 lít khí Cl2 (đktc). Số mol Fe có trong 18,5 gam hỗn hợp X là A. 0,12 mol B. 0,15 mol C. 0,1 mol D. 0,08 mol
Đọc tiếp
Hỗn hợp X gồm Zn, Fe, Cu. Cho 18,5 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được 4,48 lit H2 (đktc). Mặt khác cho 0,15 mol hỗn hợp X phản ứng vừa đủ với 3,92 lít khí Cl2 (đktc). Số mol Fe có trong 18,5 gam hỗn hợp X là
A. 0,12 mol
B. 0,15 mol
C. 0,1 mol
D. 0,08 mol
Đáp án C
Đặt số mol mỗi kim loại trong 18,5 gam hỗn hợp lần lượt là a, b, c.
Ta có: mhh X =65a + 56b + 64c; n H 2 = a + b = 3 , 92 22 , 4 = 0 , 175 mol
Có số phân tử Cl2 phản ứng trung bình với hỗn hợp X:
n Cl 2 n X = 0 , 175 0 , 15 = 7 6 = ( a + 1 , 5 b + c ) ( a + b + c )
Từ đó ta có a - 2b + c = 0.
Tóm lại ta sẽ có a = b = c = 0,1 mol.
Vậy trong 18,5g hỗn họp X sẽ có 0,1 mol Fe
Chú ý:
Dung dịch axit như dung dịch HCl, HBr, HI hoặc dung dịch H2SO4 có khả năng phản ứng với các kim loại đứng trước H trong dãy điện hóa, tức là trong bài này phản ứng với Zn và Fe tạo ra ZnCl2 và FeCl2.
- Clo có khả năng phản ứng với hầu hết các kim loại (trừ Au, Pt) thậm chí còn có khả năng phản ứng với Ag ở điều kiên thích hợp và đưa kim loại lên số oxi hóa cao nhất vì vậy sản phẩm là ZnCl2,CuCl2,FeCl3
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Cu, Fe, Mg. Nếu cho 10,88 gam X tác dụng với clo dư thì sau phản ứng thu được 28,275 gam hỗn hợp muối khan. Mặt khác, 0,44 mol X tác dụng với dung dịch HCl dư thì thu được 5,376 lít H2 (đktc). Phần trăm khối lượng của Cu trong X là: A. 67,92% B. 37,23% C. 43,52% D. 58,82%
Đọc tiếp
Hỗn hợp X gồm Cu, Fe, Mg. Nếu cho 10,88 gam X tác dụng với clo dư thì sau phản ứng thu được 28,275 gam hỗn hợp muối khan. Mặt khác, 0,44 mol X tác dụng với dung dịch HCl dư thì thu được 5,376 lít H2 (đktc). Phần trăm khối lượng của Cu trong X là:
A. 67,92%
B. 37,23%
C. 43,52%
D. 58,82%
Đáp án D
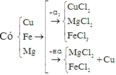
Theo định luật bảo toàn khối lượng ta có:
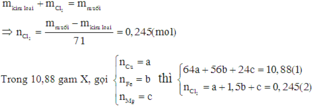
Khi cho (a + b + c) mol X tác dụng với dung dịch HCl dư thì thu được (b + c) mol H2.
Khi cho 0,44 mol X tác dụng với dung dịch HCl dư thì thu được 0,24 mol H2.
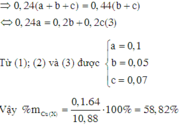
Đúng 0
Bình luận (0)
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là? A. 24,7 gam. B. 31,8 gam C. 18,3 gam D. 25,4 gam.
Đọc tiếp
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 24,7 gam.
B. 31,8 gam
C. 18,3 gam
D. 25,4 gam.
Đáp án D
Có n H 2 = 0,2 → n F e = 0,2 => m F e C l 2 = 0,2. 127 = 25,4 gam.
Đúng 0
Bình luận (0)
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là ? A. 24,7 gam. B. 31,8 gam. C. 18,3 gam. D. 25,4 gam.
Đọc tiếp
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là ?
A. 24,7 gam.
B. 31,8 gam.
C. 18,3 gam.
D. 25,4 gam.
Đáp án D
Có n(H2) = 0,2 → n(Fe) = 0,2 => m(FeCl2) = 0,2. 127 = 25,4 gam.
Đúng 0
Bình luận (0)