Trong muối đồng sunfat ngậm nước CuSO4.nH2O lượng cu chiếm 25,6%. Tìm n

Những câu hỏi liên quan
Trong muối ngâm nước CuSO4 trong đó Cu chiếm 25,6% . Xác định ct của muối ngậm nước
Đặt công thức của muối ngậm nước cần tìm là \(CuSO_4.nH_2O\)
Theo đề, Cu chiếm 25,6%
Ta có: \(\dfrac{64.100}{160+18n}=25,6\)
\(<=> 6400 = 4096+460,8n\)
\(<=> n = 5\)
Vậy công thức muối ngậm nước cần tìm là \(CuSO_4.5H_2O\)
Đúng 0
Bình luận (0)
xác định công thức muối ngậm nước CuSO4 .n.H2O trong đó Cu chiếm 25,6%
MCuSO4.nH2O=64:25,6%=250(g/mol)
n=\(\dfrac{250-160}{18}=5\)
Vậy CTHH của muối là CuSO4.5H2O
Đúng 0
Bình luận (2)
1. Tính số mol khối lượng số nguyên tử các nguyên tố có trong các hợp chất sau:
a. 8,8 g CO2
b. 16g CuSO4
c. 3,2 g Fe2(SO4)3
2. Tính thành phần % về khối lượng của Nitơ trong các loại phân đạm sau: NH4 NO3 ( đạm 2 lá); (NH4)2 SO4 (đạm 1 lá); (NH2)2 CO (đạm urê). So sánh tỉ lệ % của Nitơ trong các loại hợp chất trên
3. Trong hai loại quặng sắt là pirit sắt (FeS2) và hematit (Fe2O3), quặng nào nhiều sắt hơn
4. Trong muối đồng sunfat ngậm nước (Cu SO4 . nH2O), lượng Cu chiếm 25,6%. Tìm n
Đọc tiếp
1. Tính số mol khối lượng số nguyên tử các nguyên tố có trong các hợp chất sau:
a. 8,8 g CO2
b. 16g CuSO4
c. 3,2 g Fe2(SO4)3
2. Tính thành phần % về khối lượng của Nitơ trong các loại phân đạm sau: NH4 NO3 ( đạm 2 lá); (NH4)2 SO4 (đạm 1 lá); (NH2)2 CO (đạm urê). So sánh tỉ lệ % của Nitơ trong các loại hợp chất trên
3. Trong hai loại quặng sắt là pirit sắt (FeS2) và hematit (Fe2O3), quặng nào nhiều sắt hơn
4. Trong muối đồng sunfat ngậm nước (Cu SO4 . nH2O), lượng Cu chiếm 25,6%. Tìm n
các bạn giải giùm mình với, mình đang cần gấp.
Thanks các bạn nhiều ! ![]()
Đúng 0
Bình luận (0)
Câu 1 bạn ghi rõ đề lại nhen
Câu 2 là : - M NH4NO3 = 14+1x4+14+16x3 = 80 (gam/mol)
% N= (14 x 2) : 80 x 100% = 35%
- M (NH4)2SO4= (14+1x4)x2+32+16x4 = 132(gam/mol)
% N= (14 x 2) : 132 x 100%= 21,21%
- M (NH2)2CO = (14+1x2)x2+12+16 = 60 (gam/mol)
% N = ( 14 x 2) : 60 x 100% = 46,67%
Vậy phân đạm urê là phân có tỉ lệ % nitơ cao nhất trong các phân trên . Tiếp đến là phân đạm 2 lá và cuối cùng là phân đạm 1 lá
Câu 3: - M FeS2 = 56+32x2 = 120 (gam/mol)
%Fe = ( 56 x 1 ) : 120 x 100% = 46,67 %
- M Fe2O3 = 56 x 2 + 16 x 3 = 160 (gam/mol)
%Fe = (56 x 2 ) : 160 x 100% = 70%
Vậy quặng sắt hematit có nhiều sắt hơn
Câu 4 : bạn ghi rõ ra nhen bạn . Chứ mình không hiểu lắm !!!
Đúng 0
Bình luận (0)
11. Trong muối sắt (III) nitrat ngậm nước Fe(NO3)3.nH2O, lượng Fe chiếm 13,86%. Tìm n.
Ta có :
$\%Fe = \dfrac{56}{242 + 18n}.100\% = 13,86\%$
$\Rightarrow n = 9$
Đúng 2
Bình luận (0)
một muối sunfat của kim loại hóa trị (2) để lâu ngày trong không khí trở thành phân tủ muối ngậm nước.Trong phân tử muối ngậm nước kim loại chiếm 25,6 phần trăm.Tìm công thức phân tử muối ngậm nước đá
Gọi công thức phân tử ngậm nước là: \(RSO_4.nH_2O\)
Đề bài quá mơ hồ . Phiền em xem lại đề bài rồi
Đúng 1
Bình luận (5)
\(CT:RSO_4\cdot nH_2O\)
\(\%R=\dfrac{R}{R+96+18n}\cdot100\%=25.6\%\)
\(\Leftrightarrow R+96+18n=2.90625R\)
\(\Leftrightarrow2.90625R-18n-96=0\)
\(BL:\)
\(n=5\Rightarrow R=64\)
\(CT:CuSO_4\cdot5H_2O\)
Chúc em học tốt !!
Đúng 2
Bình luận (3)
Bài này quá dễ ,nếu em không làm đc thì nên ra khỏi đội bồi dưỡng hóa em nhé!
Đúng 0
Bình luận (1)
khi cô cạn dd FeSO4 thì muối sunfat kết tinh với nước để tạo thành 69,5g muối ngậm nước FeSO4.nH2O. Xác định n
Em xem đề có thiếu không nè, do chỉ cho từng đấy gam muối thì chưa đủ dữ kiện đâu.
Đúng 0
Bình luận (2)
PTHH : Fe + H2SO4 →→ FeSO4 + H2
Có : nH2 = 8,4/22,4 = 0,375(mol)
Theo PT ⇒⇒ nA = nH2 = 0,375(mol)
*Gọi CTHH dạng TQ của hidrat hóa là FeSO4.nH2O
Theo PT ⇒⇒ nFeSO4 = nH2 = 0,375(mol)
⇒⇒ nFeSO4.nH2O = 0,375(mol)
⇒⇒ MFeSO4.nH2O = m/n = 104,25/0,375 = 278 (g)
hay 56 + 32+ 4.16 + x . 18= 278
⇒⇒ x = 7
Vậy CTHH của hidrat hóa là FeSO4.7H2O
Đúng 0
Bình luận (0)
Trong muối ngậm nước FeSO4.nH2O, phần trăm về khối lượng của Fe là 20,144%. Tình công thức hoá học của muối ngậm nước
có mFe/Mx=0.20144
\(\Rightarrow\) Mx=278 rồi tính được n=7
ct FeSO4.7H20
Đúng 0
Bình luận (0)
Một muối sunfat của kim loại hóa trị II ngậm nước có phân tử khối 278 gam và khối lượng nước kết tinh chiếm 45,324%. Tìm công thức hóa học của muối trên.
Gọi công thức muối ngậm nước có dạng: RSO 4 . nH 2 O
Theo đề bài ta có hệ phương trình:
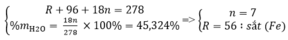
Vậy công thức của muối sắt là: FeSO 4 . 7 H 2 O
Đúng 0
Bình luận (0)
Trong tự nhiên Cu có 2 đồng vị là "Cu và Cu, trong đó Cu chiếm 73%
a. Xác định số khối A của đồng vị thứ 2. Biết nguyên tử khối trung bình của Cu là 63,54.
b. Tính % khối lượng của 6 Cu trong phân tử muối ngậm nước CUSO4.5H2O.



























