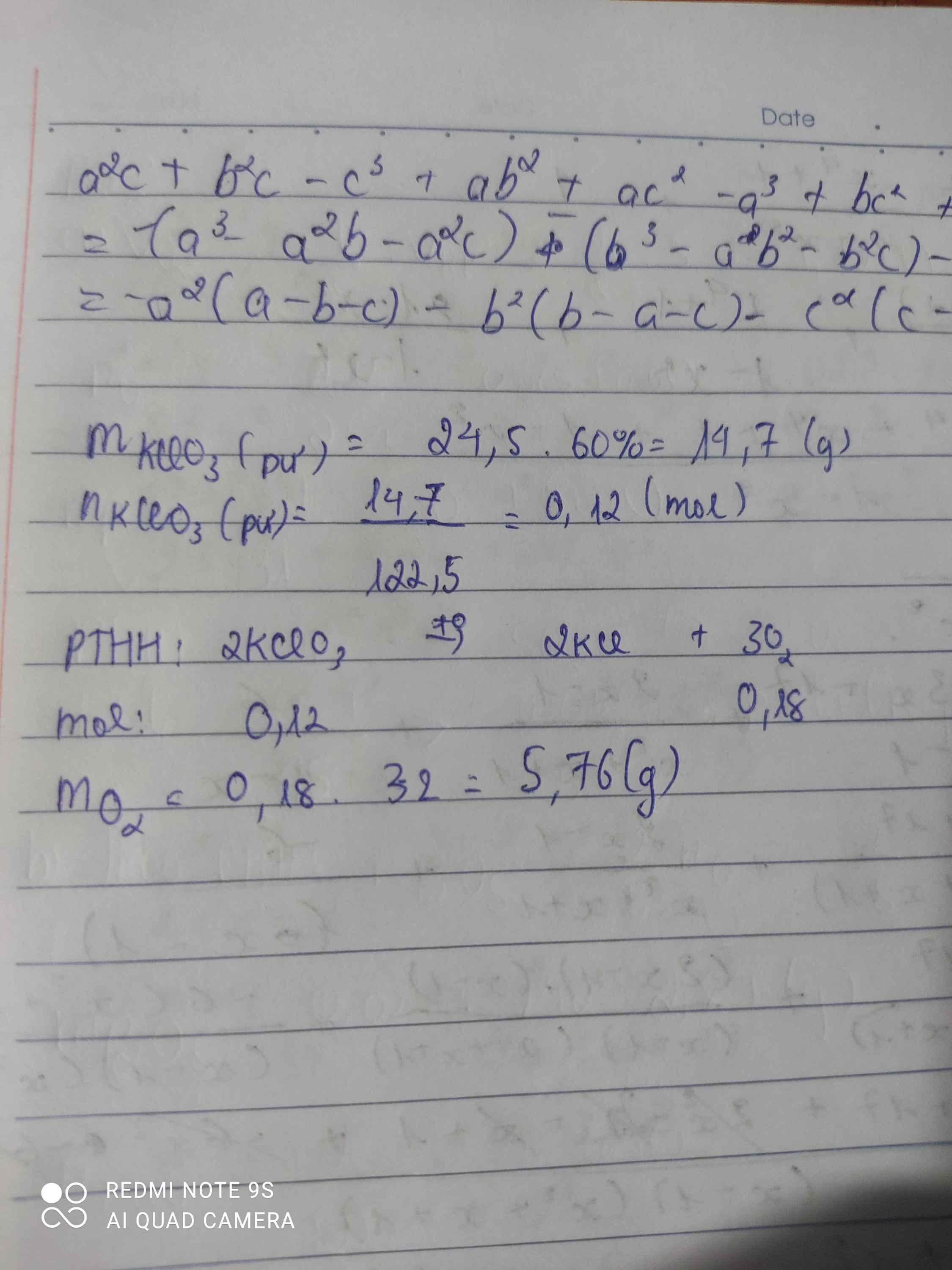Tính hiệu suất phản ứng điều chế oxi từ kaliclorat biết rằng đi từ 24,5g KClO3 thu được 5,376 lít khí oxi (đktc).

Những câu hỏi liên quan
điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60%
Số mol KClO3 là:
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH
\(2KClO_3\rightarrow2KCl+3O_2\)
0,2 mol.....................0,3mol
lượng oxi thu dc trên lý thuyết là:
\(m_{O_2}=0,3.32=9.6\left(g\right)\)
Lượng oxi thu dc thực tế là:
\(m_{O_2thucte}=9,6.60\%=5,76\left(g\right)\)
Đúng 0
Bình luận (0)
Ta có \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH : 2KClO3 \(\underrightarrow{t^0}\)2KCl + 3O2
0,2 0,3 (mol)
Mà H = 60 %
\(\Rightarrow n_{O_2}=0,3.60\%=0,18\left(mol\right)\)
\(=>m_{O_2}=0,18.32=5,76\left(g\right)\)
Đúng 0
Bình luận (1)
điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60% làm bằng 2 cách
C1
\(m_{KClO_3\left(pư\right)}=\dfrac{24,5.60}{100}=14,7\left(g\right)\)
\(n_{KClO_3\left(pư\right)}=\dfrac{14,7}{122,5}=0,12\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,12--------->0,12--->0,18
=> \(m_{O_2}=0,18.32=5,76\left(g\right)\)
C2: \(m_{KCl}=0,12.74,5=8,94\left(g\right)\)
Theo ĐLBTKL: \(m_{KClO_3\left(pư\right)}=m_{KCl}+m_{O_2}\)
=> \(m_{O_2}=14,7-8,94=5,76\left(g\right)\)
Đúng 5
Bình luận (0)
ta có
\(n_{KClO_3}=\dfrac{24.5}{122,5}=0,2\left(mol\right)\)
PTHH : \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,2 0,3 ( mol)
Mà H = 60 %
\(\Rightarrow n_{O_2}=0,3.60\%=0,18\left(mol\right)\\ \Rightarrow m_{O_2}=0,18.32=5,76\left(g\right)\)
Đúng 0
Bình luận (3)
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat
K
C
l
O
3
(chất rắn màu trắng). Khi đun nóng 24,5g
K
C
l
O
3
, chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Đọc tiếp
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat K C l O 3 (chất rắn màu trắng). Khi đun nóng 24,5g K C l O 3 , chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)
Đúng 0
Bình luận (0)
câu 9 : trong phòng thí nghiệm điều chế khí oxi bằng cách nhiệt phân muối kaliclorat
a) viết phương trình phản ứng
b) muốn điều chế 4,48 gam khí oxi (đktc) cần dùng bao nhiêu gam KCLO3 sau phản ứng thu được bao nhiêu gam chất rắn
a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
Đúng 1
Bình luận (0)
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)
Đúng 3
Bình luận (0)
Cho sơ đồ phản ứng sau : KClO3——-> KCl + O2 a, hãy hoàn thành phương trình phản ứng b, Tính số mol và khối lượng Kaliclorat (KClO3) cần dùng để điều chế 11,2 lít khí oxi(O2) (đktc) ( biết : K = 39, Cl= 35,5 ,O=16)
\(n_{O_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ PTHH:2KClO_3-^{t^o}>2KCl+3O_2\)
tỉ lệ 2 : 2 : 3
n(mol) `1/3`<------------`1/3`<-----`0,5`
\(m_{KClO_3}=n\cdot M=\dfrac{1}{3}\cdot\left(39+35,5+16\cdot3\right)\approx40,83\left(g\right)\)
Đúng 3
Bình luận (0)
Để điều chế khí oxi trong phòng thí nghiệm, người ta nung nóng 55,125 gam kali clorat KClO3 ở nhiệt độ cao với chất
xúc tác MnO2. Tính thể tích khí oxi thu được ở đktc, biết hiệu suất của phản ứng đạt 85%.
\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)
Đúng 4
Bình luận (0)
2KClO3-to>2KCl+3O2
0,45---------------------0,675 mol
n KClO3=\(\dfrac{55,125}{122,5}\)=0,45 mol
=>H=85%
=>VO2=0,675.22,4.\(\dfrac{85}{100}\)=12,852l
Đúng 3
Bình luận (1)
Khi phân hủy có xúc tác 122,5g Kaliclorat (KClO3) thể tích khí oxi (đktc) thu được là :
A. 48 lít
B. 24,5 lít
C. 67,2 lít
D. 33,6 lít
Nhiệt phân hoàn toàn 31,6 gam KMnO4, thu được V lít O2 (đktc), biết hiệu suất phản ứng 80% . Giá trị của V là
A. 2,24
B. 1,792
C. 10,08
D. 8,96
Xem thêm câu trả lời
Điều chế khí oxi bằng cách nhiệt phân 1mol KClO3 thì thu được 43,2 gam khí oxi và một lượng kali clorua (KCl) . Tính hiệu suất phản ứng ?
\(n_{O_2}=\dfrac{43.2}{32}=1.35\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(0.9...........................1.35\)
\(H\%=\dfrac{0.9}{1}\cdot100\%=90\%\)
Đúng 3
Bình luận (1)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______1_____________1,5 (mol)
⇒ mO2 (lí thuyết) = 1,5.32 = 48 (g)
Mà: mO2 (thực tế) = 43,2 (g)
\(\Rightarrow H\%=\dfrac{43,2}{48}.100\%=90\%\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (1)
\(n_{O_2}\)=\(\dfrac{43,2}{32}=1,35\left(mol\right)\)
PTHH 2KClO3-----to--->2KCl +3O2
=>\(n_{O_2\left(lt\right)}=1.\dfrac{3}{2}=1,5\left(mol\right)\)
=>H%=\(\dfrac{1,35}{1,5}.100\%=90\%\)
Đúng 0
Bình luận (0)
Trg phòng thí nghiệm. Khi điều chế khí oxi,người ta dùng 12,25g KCLO3. Hãy tính thể tích khí oxi thu được ở đktc. Biết hiệu suất pư dư đạt 80%
PTHH :
\(2KClO_3\overrightarrow{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
Theo PTHH :
\(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,15\left(mol\right)\)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(V_{O_{2thucte}}=3,36.80\%=2,688\left(l\right)\)
Đúng 2
Bình luận (2)