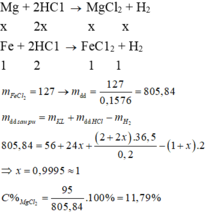18. Trộn 3 dd HCl có nồng độ lần lượt là 0,1M , 0,3M và 0,5M với thể tích bằng nhau thu đc dd HCl x (M). Xác định giá trị của x.
20. Hỗn hợp X gồm Fe và Mg có khối lượng bằng nhau. Hoà tận hoàn toàn X =1 lượng vừa đủ , dd HCl 20% thứ đc dd Y. Xác định nồng độ % của FeCl2 trong Y?