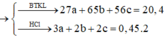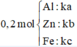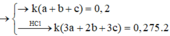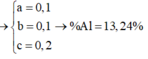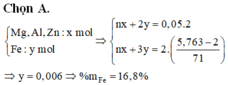1: Cho 23,1 gam hỗn hợp X ( gồm Cl2 và Br2 ) có tỉ lệ mol 1:1 tác dụng vừa đủ với 8,85
gam hỗn hợp Y gồm Fe và Zn. Tính % khối lượng của Fe trong Y ?
2: Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml
dung dịch NaOH 4M (ở nhiệt độ thường).
a. Viết phương trình hoá học của các phản ứng xảy ra.
b. Xác định nồng độ mol của những chất có trong dung dịch sau phản ứng (thể tích dd
thay đổi không đáng kể).
3: Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam
magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác
định thành phần phần trăm theo khối lượng hỗn hợp A.
4: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai
nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử Z\(_X\) <Z\(_Y\) )
vào dung dịch AgNO 3 (dư), thu được 8,61 gam kết tủa.
- Xác định CT 2 muối NaX và NaY ?
- Tính phần trăm khối lượng của NaX trong hỗn hợp ban đầu

Những câu hỏi liên quan
Cho 23,1 gam hỗn hợp X ( gồm Cl2 và Br2 ) có tỉ lệ mol 1:1 tác dụng vừa đủ với 8,85gam hỗn hợp Y ( Fe và Zn) Tính % khối lượng của Fe trong Y ?
\(n_{Cl2}=n_{Br2}=a\left(mol\right)\)
\(71a+160a=23,1\)
\(\Rightarrow a=0,1\left(mol\right)\)
Gọi số mol của Fe là x , số mol của Zn là y
\(\Rightarrow\left\{{}\begin{matrix}56x+65y=8,5\\3x+2y=0,1.2+0,1.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\frac{9}{83}\\y=\frac{31}{830}\end{matrix}\right.\)
\(\Rightarrow\%m_{Fe}=\frac{\frac{9}{83}.56}{8,5}.100\%=71,44\%\)
nCl2=nBr2=a(mol)
71a+160a=23,1
⇒a=0,1(mol)
Gọi số mol của Fe là x , số mol của Zn là y
⇒{56x+65y=8,53
x+2y=0,1.2+0,1.2
⇒{x=9\83
y=31\830
⇒%mFe=(9\83).56\8,5.100%=71,44%
Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là A. Mg B. Cu. C. Al D. Zn.
Đọc tiếp
Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là
A. Mg
B. Cu.
C. Al
D. Zn.
Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
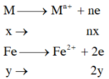
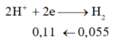
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
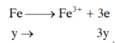
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C
Đúng 0
Bình luận (0)
Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi tác dụng với dung dịch HCl dư, thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc, dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1:3. Kim loại M là A.Kẽm B.Nhôm C. Đồng D.Magie
Đọc tiếp
Cho 1,37 gam hỗn hợp X gồm Fe và kim loại M hóa trị không đổi tác dụng với dung dịch HCl dư, thấy giải phóng 1,232 lít khí H2 (đktc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc, dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1:3. Kim loại M là
A.Kẽm
B.Nhôm
C. Đồng
D.Magie
Cho 30,2 gam hỗn hợp X (gồm Cl2 và Br2) có tỉ lệ mol 2:1 tác dụng vừa đủ với Zn . Tính khối lượng muối thu được
Xem chi tiết
Theo gt ta có: $n_{Cl_2}=0,2(mol);n_{Br_2}=0,1(mol)$
Bảo toàn e ta có: $n_{Zn}=0,3(mol)\Rightarrow m_{muoi}=m_{Zn}+m_{khi}=49,7(g)$
Đúng 2
Bình luận (1)
Cho 1,37g hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đkc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là A. Mg B. Cu C. Al D. Zn
Đọc tiếp
Cho 1,37g hỗn hợp X gồm Fe và kim loại M hoá trị không đổi tác dụng với dung dịch HCl dư thấy giải phóng 1,232 lít khí H2 (đkc). Mặt khác hỗn hợp X trên tác dụng vừa đủ với lượng khí Cl2 điều chế được bằng cách cho 3,792 gam KMnO4 tác dụng với dung dịch HCl đặc dư. Tỉ lệ số mol của Fe và M trong hỗn hợp là 1: 3. Kim loại M là
A. Mg
B. Cu
C. Al
D. Zn
Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn
Đúng 0
Bình luận (0)
Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 5,04 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.b. Tính a?c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Đọc tiếp
Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 5,04 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.
b. Tính a=?
c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\) => 65a + 56b + 27c = 10,65 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> \(n_{H_2}=a+b+1,5c=\dfrac{5,04}{22,4}=0,225\left(mol\right)\) (2)
PTHH: Zn + Cl2 --to--> ZnCl2
2Fe + 3Cl2 --to--> 2FeCl3
2Al + 3Cl2 --to--> 2AlCl3
=> \(n_{Cl_2}=a+1,5b+1,5c=\dfrac{5,6}{22,4}=0,25\left(mol\right)\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\\c=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Al}=0,05.27=1,35\left(g\right)\end{matrix}\right.\)
a) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{6,5}{10,65}.100\%=61,033\%\\\%m_{Fe}=\dfrac{2,8}{10,65}.100\%=26,291\%\\\%m_{Al}=\dfrac{1,35}{10,65}.100\%=12,676\%\end{matrix}\right.\)
b) nHCl = 2a + 2b + 3c = 0,45 (mol)
=> mHCl = 0,45.36,5 = 16,425 (g)
=> \(a\%=C\%=\dfrac{16,425}{200}.100\%=8,2125\%\)
c) mdd sau pư = 10,65 + 200 - 0,225.2 = 210,2 (g)
=> \(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{210,2}.100\%=6,47\%\\C\%_{FeCl_2}=\dfrac{0,05.127}{210,2}.100\%=3,02\%\\C\%_{AlCl_3}=\dfrac{0,05.133,5}{210,2}.100\%=3,176\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Bài 7: Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 10,08 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.b. Tính a?c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Đọc tiếp
Bài 7: Cho 10,65 gam hỗn hợp X gồm Zn, Fe và Al tác dụng hoàn toàn với 200 gam dung dịch HCl a% vừa đủ thì thu được 10,08 lit khí ở đktc. Mặt khác, cho 10,65 gam hỗn hợp X tác dụng vừa đủ với 5,6 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
a. Tính phần trăm khối lượng của từng KL trong hỗn hợp ban đầu.
b. Tính a=?
c. Tính C% các chất trong dung dịch thu được sau phản ứng.
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 10,08 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,16 lít Cl2. Tính thành phần phần % về khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc) A.26,47% B. 19,85% C.33,09% D.13,24%
Đọc tiếp
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 10,08 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,16 lít Cl2. Tính thành phần phần % về khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
A.26,47%
B. 19,85%
C.33,09%
D.13,24%
cho 11,2 lít hỗn hợp khí X gồm Cl2 và o2 tác dụng vừa đủ với 23,45 gam hỗn hợp Y gồm Al và Fe thu được 51,15 gam hônc hợp Z gồm các oxit và muối clorua, Toàn bộ Z phản ứng tối đa với 0,2 mol Kmno4 trong dung dịch h2so2 loãng, Khối lượng của Fe trong Y là ?
Cho 2 gam hỗn hợp X gồm Mg, Al, Fe và Zn tác dụng với dung dịch hỗn hợp chứa HCl và H2SO4 loãng dư, sau phản ứng thu 0,05 mol khí. Mặt khác, cho 2 gam hỗn hợp X tác dụng với Cl2 dư, sau phản ứng thu được 5,763 gam hỗn hợp muối khan. Phần trăm khối lượng Fe trong X là A. 16,8% B. 8,4% C. 22,4% D. 19,2%
Đọc tiếp
Cho 2 gam hỗn hợp X gồm Mg, Al, Fe và Zn tác dụng với dung dịch hỗn hợp chứa HCl và H2SO4 loãng dư, sau phản ứng thu 0,05 mol khí. Mặt khác, cho 2 gam hỗn hợp X tác dụng với Cl2 dư, sau phản ứng thu được 5,763 gam hỗn hợp muối khan. Phần trăm khối lượng Fe trong X là