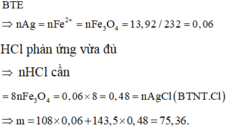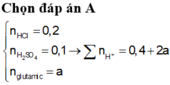Hòa tan m gam cho vừa đủ 200ml dung dịch HCl 1,5M. Tìm giá trị m

Những câu hỏi liên quan
Hòa tan hoàn toàn a gam Al2O3 cần dùng vừa đủ với 200ml dung dịch H2SO4( loãng) 1,5M
a) Tìm giá trị a
b) Tính khối lượng muối tạo thành
Đổi 200ml = 0,2 lít
Ta có: \(C_{M_{H_2SO_4}}=\dfrac{n_{H_2SO_4}}{0,2}=1,5M\)
=> \(n_{H_2SO_4}=0,3\left(mol\right)\)
a. PTHH: Al2O3 + 3H2SO4 ---> Al2(SO4)3 + 3H2O
Theo PT: \(n_{Al_2O_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\)
=> \(a=m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
b. Theo PT: \(n_{Al_2\left(SO_4\right)_3}=n_{Al}=0,1\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2\left(g\right)\)
Đúng 4
Bình luận (0)
Bài 11: Để trung hòa 200ml dung dịch NaOH 1,5M cần dùng vừa đủ 120ml dd H2SO4 xM.a. Tính giá trị của x.b. Tính khối lượng muối thu được sau phản ứng? Bài 12: Để hòa tan hết 16,2 gam Al cần dùng vừa đủ 200ml dung dịch H2SO4 XM.a. Tính giá trị của X.b. Tính thể tích H2 thu được (đktc). Bài 13: Để hòa tan hết 9,6 gam Fe2O cần dùng vừa đủ 150gam dung dịch HCl x%.a. Tính giá trị của X.b. Tính khối lượng muối thu được sau phản ứng?
Đọc tiếp
Bài 11: Để trung hòa 200ml dung dịch NaOH 1,5M cần dùng vừa đủ 120ml dd H2SO4 xM.
a. Tính giá trị của x.
b. Tính khối lượng muối thu được sau phản ứng?
Bài 12: Để hòa tan hết 16,2 gam Al cần dùng vừa đủ 200ml dung dịch H2SO4 XM.
a. Tính giá trị của X.
b. Tính thể tích H2 thu được (đktc).
Bài 13: Để hòa tan hết 9,6 gam Fe2O cần dùng vừa đủ 150gam dung dịch HCl x%.
a. Tính giá trị của X.
b. Tính khối lượng muối thu được sau phản ứng?
Bài 13 :
\(a)n_{Fe_2O_3} = \dfrac{9,6}{160} = 0,06(mol)\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ n_{HCl} = 6n_{Fe_2O_3} = 0,36(mol)\\ C\%_{HCl} = \dfrac{0,36.36,5}{150}.100\% = 8,76\%\\ \Rightarrow X = 8,76 b) n_{FeCl_3} = 2n_{Fe_2O_3} = 0,12(mol)\\ m_{FeCl_3} = 0,12.162,5 =19,5(gam)\)
Đúng 2
Bình luận (0)
Bài 11 :
\(a) n_{NaOH} = 0,2.1,5 = 0,3(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,15(mol)\\ \Rightarrow x = \dfrac{0,15}{0,12}= 1,25(M)\\ b) n_{Na_2SO_4} = n_{H_2SO_4} = 0,15(mol)\\ m_{Na_2SO_4} = 0,15.142 = 21,3(gam)\)
Đúng 1
Bình luận (0)
Bài 12 :
\(a)n_{Al} = \dfrac{16,2}{27} = 0,6(mol)\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{H_2SO_4} = n_{H_2} = \dfrac{3}{2}n_{Al} = 0,9(mol)\\ \Rightarrow X = \dfrac{0,9}{0,2} =4,5(M)\\ b) V_{H_2} = 0,9.22,4 = 20,16(lít)\)
Đúng 1
Bình luận (0)
Hòa tan hết 13,92 gam Fe3O4 trong dung dịch HCl vừa đủ, thu được dung dịch X. Cho dung dịch AgNO3 vào X, thu được m gam kết tủa. Giá trị của m là
A. 75,36.
B. 81,84.
C. 68,88.
D. 88,32
Hòa tan hết m gam aluminium vào 200ml dung dịch hydrochloric axit 1,5M vừa đủ xác định nồng độ mol của chất tan thu được sau phản ứng
\(n_{HCl}=C_M.V=1,5.0,2=0,3\left(mol\right)\)
PTHH :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,1 0,3 0,1
\(C_{M_{AlCl_3}}=\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Đúng 5
Bình luận (0)
Cho m gam axit glutamic vào dung dịch NaOH thu được dung dịch X chứa 23,1 gam chất tan. Để tác dụng vừa đủ với chất tan trong X cần dùng 200ml dung dịch HCl 1M và H2SO4 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối. Giá trị của m là: A. 14,7 B. 20,58 C. 17,64 D. 22,05
Đọc tiếp
Cho m gam axit glutamic vào dung dịch NaOH thu được dung dịch X chứa 23,1 gam chất tan. Để tác dụng vừa đủ với chất tan trong X cần dùng 200ml dung dịch HCl 1M và H2SO4 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối. Giá trị của m là:
A. 14,7
B. 20,58
C. 17,64
D. 22,05
Hòa tan m gam nhôm vào lượng vừa đủ 200 ml dung dịch HCl 1,5M thu được muối và V lít khí H2 (0⁰C, 1atm)
a) viết phương trình hóa học của phản ứng xảy ra
b) tính giá trị V và m
\(a,2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{HCl}=0,2.1,5=0,6\left(mol\right)\\ n_{H_2}=\dfrac{3}{6}.0,6=0,3\left(mol\right);n_{Al}=\dfrac{2}{6}.0,6=0,2\left(mol\right)\\ b,V=V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ m=m_{Al}=0,2.27=5,4\left(g\right)\)
Đúng 1
Bình luận (0)
Cho m gam anilin tác dụng vừa đủ với 200ml dung dịch B r 2 1,5M, thu được x gam kết tủa. Giá trị của x là
A. 33,3.
B. 33,0.
C. 99,9.
D. 99,0
Hòa tan m gam Fe bằng dung dịch HCl vừa đủ thu được dung dịch Y. Cô cạn dung dịch Y thu được 25,4 gam muối khan. Vậy giá trị của m là A. 16,8 gam B. 11,2 gam C. 6,5 gam D. 5,6 gam
Đọc tiếp
Hòa tan m gam Fe bằng dung dịch HCl vừa đủ thu được dung dịch Y. Cô cạn dung dịch Y thu được 25,4 gam muối khan. Vậy giá trị của m là
A. 16,8 gam
B. 11,2 gam
C. 6,5 gam
D. 5,6 gam
Hòa tan m gam Fe bằng dung dịch HCl vừa đủ thu được dung dịch Y. Cô cạn dung dịch Y thu được 25,4 gam muối khan. Vậy giá trị của m là
A. 16,8 gam.
B. 11,2 gam.
C. 6,5 gam.
D. 5,6 gam.
Đáp án : B
Fe + 2HCl à FeCl2 + H2
=> nFe = nFeCl2 = 0,2 mol
=> m = 11,2g
Đúng 0
Bình luận (0)