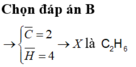một hh khí X gồm CH4, C2H2 có d X/kk=0.6 cho biết thể tích khí õi cần dùng để đốt cháy hoàn toàn 3l hốn hợp X ns trên biết thể tích các khí đo ở cùng dk nhiệt độ và áp suất

Những câu hỏi liên quan
Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm C3H6, CH4, CO (thể tích CO gấp hai lần thể tích CH4), thu được 24,0 ml CO2 (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí H2 là: A. 12,9. B. 25,8. C. 22,2. D. 11,1
Đọc tiếp
Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm C3H6, CH4, CO (thể tích CO gấp hai lần thể tích CH4), thu được 24,0 ml CO2 (các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí H2 là:
A. 12,9.
B. 25,8.
C. 22,2.
D. 11,1
Đặt VC3H6 = a ; VCH4 = b ⇒ VCO = 2b
Có VC3H6 + VCH4 + VCO = Vhỗn hợp = a + 3b = 20 (1)
Áp dụng định luật bảo toàn nguyên tố C có:
VCO2 = 3VC3H6 + VCH4 + VCO ⇒ 24 = 3a + 3b (2)
Từ (1) và (2) ⇒ a = 2 ; b = 6
⇒ nC3H6 : nCH4 : nCO = 2 : 6 : 12 = 1 : 3 : 6
Gỉa sử: nC3H6 = 1 ⇒ nCH4 = 3 ⇒ nCO = 6
MX = ( mC3H6 + mCH4 + mCO ) / nX = (42 + 16.3 + 6.28) / (1+3+6) = 25,8
⇒ dX/H2 = 12,9
Đáp án A
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm
C
3
H
6
,
C
H
4
,
C
O
(thể tích CO gấp hai lần thể tích
C
H
4
), thu được 24,0 ml CO2 (các thể tích khí đo cùng ở điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí hiđro là A. 22,2 B. 25,8 C. 12,9 D. 11,1
Đọc tiếp
Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm C 3 H 6 , C H 4 , C O (thể tích CO gấp hai lần thể tích C H 4 ), thu được 24,0 ml CO2 (các thể tích khí đo cùng ở điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí hiđro là
A. 22,2
B. 25,8
C. 12,9
D. 11,1
Chọn C
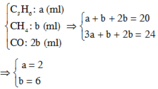
M ¯ = 2.42 + 6.16 + 12.28 20 = 25 , 8 ⇒ d x / H 2 = 25 , 8 2 = 12 , 9
Đúng 0
Bình luận (0)
Để đốt cháy hoàn toàn 24 lit CH4 cần dùng bao nhiêu lit không khí? Biết Oxi chiếm 20% thể tích không khí và các khí đo ở cùng điều kiện nhiệt độ, áp suất. *
A. 48 lit.
B. 24 lit
C. 240 lit.
D. 120 lit
\(CH_4+2O_2\underrightarrow{^{t^0}}CO_2+2H_2O\)
\(24.........48\)
\(V_{O_2}=48\left(l\right)\)
\(V_{kk}=5V_{O_2}=5\cdot48=240\left(l\right)\)
Đúng 2
Bình luận (0)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
____24___48 (lít)
Mà: VO2 = 20%Vkk
\(\Rightarrow V_{kk}=\dfrac{48}{20\%}=240\left(l\right)\)
⇒ Đáp án: C
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
Theo PTHH :
V O2 = 2V CH4 = 24.2 = 48(lít)
V không khí = V O2 /20% = 48/20% = 240(lít)
Đáp án C
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hidrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là A. C2H4 B. C2H6 C. C3H8 D. CH4
Đọc tiếp
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hidrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
A. C2H4
B. C2H6
C. C3H8
D. CH4
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là A. C2H4. B. C2H6. C. C3H8. D. CH4.
Đọc tiếp
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
A. C2H4.
B. C2H6.
C. C3H8.
D. CH4.
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là A. C2H4. B. C2H6. C. C3H8. D. CH4.
Đọc tiếp
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
A. C2H4.
B. C2H6.
C. C3H8.
D. CH4.
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là A. C2H6 B. C2H4 C. CH4 D. C3H8
Đọc tiếp
Đốt cháy hoàn toàn 1 lít hỗn hợp khí gồm C2H2 và hiđrocacbon X sinh ra 2 lít khí CO2 và 2 lít hơi H2O (các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
A. C2H6
B. C2H4
C. CH4
D. C3H8
Đốt cháy hoàn toàn 28 lít hỗn hợp khí gồm CH4 và C2H2 (trong đó CH4 chiếm 20% về thể tích). Hãy tính:
Thể tích không khí cần dùng (biết oxi chiếm 20% thể tích không khí)
Thể tích khí CO2 tạo thành. Biết các khí đều đo ở đktc.
Đốt cháy hoàn toàn 28 lít hỗn hợp gồm CH4 và C2H2 trong đó CH4 chiếm 20% về thể tích. Hãy tính
a) Thể tích không khí cần dùng biết oxi chiếm 20% thể tích không khí
b) Thể tích khí CO2 tạo thành biết các khí đều đo ở đktc
-----------------------------
CH4 chiếm 20% trong 28 lit hỗn hợp
=> V CH4 = 20%.28 = 5,6 lit
=> nCH4 = V/22,4 = 0,25 mol
=> V C2H2 = 28 - 5,6 = 22,4 lit
=> n C2H2 = V/22,4 = 1 mol
CH4 + 2O2 ---------> CO2 + 2H2O
0,25 0,5 0,25
C2H2 + 5/2O2 -------------> 2CO2 + H2O
1 2,5 2
=> V kh + 2,5).100/20.22,4 = 336 lit
=> VCO2 = (0,25 + 2).22,4 = 50,4 lit
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 1l hh X gồm C2H4 và hidrocacbon A thu được 3l CO2 à 3l H2O ( thể tích khí ở cùng đk nhiệt độ và áp suất ). Xđ CTPT của A
\(V_{CO_2} = V_{H_2O}\Rightarrow \text{A là anken}\\ \)
Số nguyên tử Ctb = \(\dfrac{V_{CO_2}}{V_X} = \dfrac{3}{1}=3\)
Vậy CTPT của A là \(C_nH_{2n}\)(n ≥ 4 ;n nguyên)
Đúng 1
Bình luận (0)