Ở đktc, 1 lít nước hoà tan 406 lít khí hidroclorua. Tính nồng độ % dung dịch axit thu được

Những câu hỏi liên quan
hòa tan 16,8 lít khí H2S ở đktc vào 174,5 gam nước thì thu được dung dịch Axit H2S. tính nồng độ phần trăm của dung dịch?
\(n_{H_2S}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\\\rightarrow m_{H_2S}=0,75.34=25,5\left(g\right)\\ m_{dd}=25,5+174,5=200\left(g\right)\\ \rightarrow C\%_{H_2S}=\dfrac{25,5}{200}.100\%=12,75\%\)
Đúng 1
Bình luận (0)
Ở điều kiện tiêu chuẩn, 1 lít nước hòa tan 350 lít khí HBr. Tính nồng độ phần trăm của dung dịch axit bromhiđric thu được.
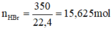
→ mHBr = 15,625 x 81 = 1265,625g;
VH2O = 1 lít ⇒ mH2O = 1000g.
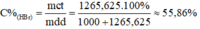
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 7,2g kim loại magie vào 300ml dung dịch HCl thu được V lít khí H2 ở đktc 1. Viết PTHH 2. Tính nồng độ mol dung dịch HCl đã dùng 3. Tính thể tích H2 sinh ra ở đktc
\(1,n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,3---->0,6------------------>0,3
\(2,C_{M\left(HCl\right)}=\dfrac{0,6}{0,3}=2M\\ 3,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Hoà tan 13gam Zn vào 300ml dung dịch H2SO4 thu được dung dịch A và V lít khí H2 ở đktc , tính V và nồng độ mol/lít của dunh dịch A , biết thể tích thay đổi không đáng kể
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
_____0,2---->0,2------>0,2----->0,2
VH2 = 0,2.22,4 = 4,48(l)
\(C_{M\left(ZnSO_4\right)}=\dfrac{0,2}{0,3}=0,667M\)
Đúng 0
Bình luận (0)
ở điều kiện tiêu chuẩn , 1 lít nước hòa tan 350 lít khí HBr . Tính nồng độ phần trăm của dung dịch axit bromhiđric thu được .
nHBr =\(\frac{350}{22,4}\) = 15,625 mol
→ mHBr = 15,625 x 81 =1265,625 g
C%HBr =\(\frac{1265,625.100}{1000+1265,625}\) = 55,86%
Đúng 0
Bình luận (0)
Ở điều kiện tiêu chuẩn, 1 lít nước hòa tan 350 lít khí HBr. Tính nồng độ phần trăm của dung dịch axit bromhidric thu được.
Hướng dẫn giải:
nHBr = = 15,625 mol
→ mHBr = 15,625 x 81 =1265,625 g
C%HBr = = 55,86%
Đúng 0
Bình luận (0)
Hoà tan 4,6 gam Na vào 100 ml nước thu được dung dich A và V lít khí H2 (đktc).
a) Tính giá trị của V?
b) Tính nồng độ mol của dung dịch A?
c) Tính nồng độ phần trăm của chất tan trong dung dịch A?
a) nNa = 4,6/23 = 0,2 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2
Mol: 0,2 ---> 0,2 ---> 0,2 ---> 0,1
VH2 = 0,1 . 22,4 = 2,24 (l)
b) CMNaOH = 0,2/0,1 = 2M
c) mH2O = 100 . 1 = 100 (g)
mNaOH = 0,2 . 40 = 8 (g)
mH2 = 0,1 . 2 = 0,2 (g)
mdd = 100 + 8 - 0,2 = 107,8 (g)
C%NaOH = 8/107,8 = 7,42%
Đúng 2
Bình luận (1)
Hoà tan 4,6 gam Na vào 100 ml nước thu được dung dich A và V lít khí H2 (đktc).
a) Tính giá trị của V?
b) Tính nồng độ mol của dung dịch A?
c) Tính nồng độ phần trăm của chất tan trong dung dịch A?
ôxi hóa hoàn toàn 8 lít khí a(đktc).sản phẩm thu được hoà tan hoàn toàn vào 85,8 g dung dịch H2SO4 60%.tính nồng độ phần trăm dung dịch axit thu đượcôxi hóa hoàn toàn 8 lít khí a(đktc).sản phẩm thu được hoà tan hoàn toàn vào 85,8 g dung dịch H2SO4 60%.tính nồng độ phần trăm dung dịch axit thu được.giúp mk vs ạ
Cho 8,96 lít khí H2 phản ứng với 7,84 lít khí Cl2 thu được V lít khí A. (thể tích các khí đo ở đktc)
a. Giá trị V = ?
b. Hòa tan lượng khí A trên vào 224,45gam nước thu được dung dịch B. Tính nồng độ % của dung dịch B
H2+Cl2->2HCl
0,35---0,7 mol
n H2=\(\dfrac{8,96}{22,4}\)=0,4 mol
n Cl2=\(\dfrac{7,84}{22,4}\)=0,35 mol
=>H2 dư :0,05 mol
=>VHCl=0,7.22,4=15,68l
b) C% HCl=\(\dfrac{0,7.36,5}{25,55+224,45}\).100=10,22%
Đúng 4
Bình luận (2)
a: \(H_2+Cl_2\rightarrow2HCl\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(n_{Cl_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
=>Cl2 thiếu, H2 dư
\(V_{HCl}=2\cdot V_{Cl_2}=0.7\left(mol\right)\)
Đúng 0
Bình luận (1)




















