Hòa tan hoàn toàn 6,5g Zn vào dung dịch HCl ta thu được ZnCl2 và H2. Cho toàn bộ lượng H2 tác dụng với 6g bột CuO đun nóng thu được 5,2g chất rắn. Tính hiệu suất phản ứng

Những câu hỏi liên quan
Hòa tan hoàn toàn 6,5g Zn vào dung dịch HCl ta thu được muối ZnCl2 và thấy có khí H2 thoát ra. Cho toàn bộ lượng khí H2 tác dụng với bột CuO đun nóng thu được 5,2g chất rắn. Tính hiệu suất phản ứng
Hòa tan hoàn toàn 6,5(g) Zn vào dung dịch HCl, ta thu được muối ZnCl2 và tháy có khí H2 thoát ra. Cho toàn bộ lượng khí H2 thu được qua 6(g) CuO đun nóng, sau phản ứng thu được 5,2(g) chất rắn. Tính hiệu suất phản ứng.
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1.................................0.1\)
\(Đặt:n_{CuO\left(pư\right)}=x\left(mol\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(x............x\)
\(m_{cr}=6-80x+64x=5.2\left(g\right)\)
\(\Rightarrow x=0.05\)
\(H\%=\dfrac{0.05}{0.075}\cdot100\%=66.67\%\)
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 6.5 gam Zn vào dung dịch HCl ta thu được muối ZnCl2 và thấy có khí H2 thoát ra. Cho toàn bộ lượng khí H2 thu được qua 6 gam CuO nung nóng, sau phản ứng thu được 5,2 gam chất rắn. Tính hiệu suất phản ứng?
Zn + 2HCl -> ZnCl2 + H2 (1)
nZn=0,1(mol)
Từ 1:
nZnCl2=nH2=nZn=0,1(mol)
mZnCl2=136.0,1=13,6(g)
VH2=0,1.22,4=2,24(lít)
CuO +H2 -> Cu + H2O (2)
Từ 2:
nO=nH2=0,1(mol)
mO=16.0,1=1,6(g)
mchất rắn còn lại=10-1,6=8,4(g)
Chúc Bạn Học Tốt
Đúng 1
Bình luận (1)
hoà tan hoàn toàn 6.5 gam zn vào dung dịch hcl ta thu được muối zncl2 và thấy có khí h2 thoát ra. Cho toàn bộ lượng khí h2 thu được qua 6 gam cuo nung nóng, sau phản ứng thu được 5,2 gam chất rắn. Tính hiệu suất phản ứng
Hòa tan hoàn toàn 6.5 gam Zn vào dung dịch HCl ta thu được muối ZnCl2 và thấy có khí thoát ra. Cho toàn bộ lượng khí H2 thu được qua 6 gam CuO đun nóng, sau phản ứng thu được 5.2 gam chất rắn. Tính hiệu suất phản ứng
cho 6g hỗn hợp mg và fe vào 200ml dung dịch hcl 1M, toàn bộ khí h2 thoát ra dẫn qua ống sứ chứ 6g cuo nung nóng, sau phản ứng có m gam chất rắn. Giả sử phản ứng giữa h2 và cuo xảy ra với hiệu suất 80%
a) tính thể tích h2 thu được ở đktc?
b) tính m
Mg+2HCl->MgCl2+H2
x---------2x
Fe+2HCl->MgCl2+H2
y------2y
Ta có :\(\left\{{}\begin{matrix}24x+56y=6\\2x+2y=0,2\end{matrix}\right.\)
=>số âm kiểm tra lại đề
Đúng 0
Bình luận (0)
Cho 13 gam Zn tác dụng hoàn toàn với 150 ml dung dịch HCl. Tính thể tích H2 điều kiện chuẩn . CM HCl, CM ZnCl2 .nếu dùng toàn bộ lượng H2 trên đem khử 12 gam CuO thì chất nào dư; chất rắn thu được?
Số mol của kẽm
nZn = \(\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,2. 22,4
= 4,48 (l)
Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
150ml = 0,15l
Nồng độ mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}=\dfrac{0,4}{0,15}=2,7\left(M\right)\)
Số mol của kẽm clorua
nZnCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Nồng độ mol của kẽm clorua
CMZnCl2 = \(\dfrac{n}{V}=\dfrac{0,2}{0,15}=1,3\left(M\right)\)
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15\left(mol\right)\)
Pt : H2 + CuO → (to) Cu + H2O\(|\)
1 1 1 1
0,2 0,15 0,15
Lập tỉ số so sánh : \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
⇒ H2 dư , CuO phản ứng hết
⇒ Tính toán dựa váo số mol của CuO
Số mol của đồng
nCu = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của đồng
mCu = nCu . MCu
= 0,15 . 64
= 9,6 (g)
Chúc bạn học tốt
Đúng 2
Bình luận (0)
nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun nóng. Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất nóng Y. Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến khi phản ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là A. 22,44 B. 28,0 C. 33,6 D. 25,2
Đọc tiếp
nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun nóng. Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất nóng Y. Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến khi phản ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là
A. 22,44
B. 28,0
C. 33,6
D. 25,2
Chọn đáp án B
Ta có
![]()
=0,2
![]()
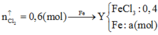
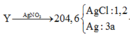
![]()
=>a=0,1(mol)
![]()
Đúng 0
Bình luận (0)
Cho 13 gam Zn tác dụng với 1 lượng dung dịch HCl vừa đủa, tính thể tích khia H2 sinh ra ở đktcb, tính khối lượng ZnCl2 tạo thànhc, lấy toàn bộ lượng khí H2 trên cho tác dụng với 8 gam CuO thì thu được bao nhiêu gam chất rắn sau phản ứng
Đọc tiếp
Cho 13 gam Zn tác dụng với 1 lượng dung dịch HCl vừa đủ
a, tính thể tích khia H2 sinh ra ở đktcb, tính khối lượng ZnCl2 tạo thànhc, lấy toàn bộ lượng khí H2 trên cho tác dụng với 8 gam CuO thì thu được bao nhiêu gam chất rắn sau phản ứnga, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,2____________0,2____0,2 (mol)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
c, \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{Cu}=n_{CuO}=0,1\left(mol\right)\Rightarrow m_{cr}=m_{Cu}=0,1.64=6,4\left(g\right)\)
Đúng 3
Bình luận (0)





















