Dùng 17.92lít khí oxi ở (đktc) đốt cháy vừa hết hỗn hợp khí x gồm H2S và CxHy thu được 10.8g nước và hỗn hợp khí B goomg SO2 và CO2 tỉ khối của khí B so với H2 là 30.Xác định CTHH của CxHy

Những câu hỏi liên quan
Đốt cháy hoàn toàn 0,5 mol hỗn hợp M gồm C4H6, C3H8 và CxHy, thu được 1,35 mol CO2 và 0,85 mol H2O. Hỗn hợp khí X chứa 0,1 mol H2 và 0,3 mol CxHy có tỉ khối so với H2 bằng A. 6,25 B. 10 C. 11,5 D. 10,75
Đọc tiếp
Đốt cháy hoàn toàn 0,5 mol hỗn hợp M gồm C4H6, C3H8 và CxHy, thu được 1,35 mol CO2 và 0,85 mol H2O. Hỗn hợp khí X chứa 0,1 mol H2 và 0,3 mol CxHy có tỉ khối so với H2 bằng
A. 6,25
B. 10
C. 11,5
D. 10,75
Dùng V lít khí O2 đốt cháy vừa hết m(g) hỗn hợp X gồm C3H8 và H2S thu được 12,6(g) nước và 13,44 lít hỗn hợp khí Y gồm CO2 và SO2.
a. Viết phương trình hóa học.
b. Tính các giá trị của V.
c. Tính giá trị của m biết dY/H2 = 27.
d. Tính tỉ khối của hỗn hợp khí X so với H2.
PTHH: C3H8 +5O2 \(\underrightarrow{t^o}\) 3CO2 + 4H2O
2H2S + 3O2 \(\underrightarrow{t^o}\) 2SO2 + 2H2O
Gọi x và y lần lượt là số mol của C3H8 và H2S
-Theo PTHH ta có:
+nH2O = \(\dfrac{12,6}{18}=0,7\left(mol\right)\)
+nY=\(\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
⇒Hệ phương trình: \(\left\{{}\begin{matrix}4x+y=0,7\\3x+y=0,6\end{matrix}\right.\)
⇒x= 0,1 ; y= 0,3 (mol) (Cái này bấm máy tính giải hệ)
+nO2= 0,1.5 + 0,3.\(\dfrac{3}{2}\)=0,95(mol)
+VO2=0,95.22,5=21,28(lit)
- mX= 0,1.44 + 0,3.34 = 14,6(gam)
-MX=\(\dfrac{14,6}{0,4}=36,5\) g/mol
-\(\dfrac{\text{dX}}{H_2}\) = \(\dfrac{36,5}{2}=18,25\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 6,72 lít hỗn hợp khí X gồm một hiđrocacbon CxHy và các bon oxit thì cần dùng vừa đủ 13,44 lít khí O2 thu được 22 g CO2 và 72 g hơi nước tìm công thức phân tử của cxhy và phần trăm theo thể tích của mỗi khí trong hỗn hợp X
\(\left\{{}\begin{matrix}C_xH_y:a\left(mol\right)\\CO:b\left(mol\right)\end{matrix}\right.=>a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn C: ax + b = 0,5
Bảo toàn H: ay = 0,8
Bảo toàn O: b + 0,6.2 = 0,5.2 + 0,4
=> b = 0,2 (mol)
=> a = 0,1 (mol)
=> x = 3 ; y = 8 => CTPT: C3H8
\(\left\{{}\begin{matrix}\%V_{C_3H_8}=\dfrac{0,1}{0,3}.100\%=33,33\%\\\%V_{CO}=\dfrac{0,2}{0,3}.100\%=66,67\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Dùng V lít khí O2 đốt cháy vừa hết m(g) hỗn hợp X gồm C3H8 và H2S thu được 12,6(g) nước và 13,44 lít hỗn hợp khí Y gồm CO2 và SO2
a. Viết các phương trình hóa học.
b. Tính các giá trị của V.
c. Tính giá trị của m biết dY/H2 = 27.
d. Tính tỉ khối của hỗn hợp khí X so với H2
a)
C3H8 + 5O2 --to--> 3CO2 + 4H2O
2H2S + 3O2 --to--> 2SO2 + 2H2O
b)
Gọi số mol C3H8, H2S là a, b (mol)
\(n_{H_2O}=\dfrac{12,6}{18}=0,7\left(mol\right)\)
\(n_{CO_2}+n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: C3H8 + 5O2 --to--> 3CO2 + 4H2O
a------5a---------->3a------>4a
2H2S + 3O2 --to--> 2SO2 + 2H2O
b--->1,5b-------->b------->b
=> 3a + b = 0,6
Và 4a + b = 0,7
=> a = 0,1 (mol); b = 0,3 (mol)
=> V = (5a + 1,5b).22,4 = 21,28 (l)
c) m = 0,1.44 + 0,3.34 = 14,6 (g)
d) \(M_X=\dfrac{m_X}{n_X}=\dfrac{14,6}{0,1+0,3}=36,5\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{36,5}{2}=18,25\)
Đúng 2
Bình luận (1)
Giả sử các khí đo ở điều kiện tiêu chuẩn.
a) C3H8 (x mol) + 5O2 (5x mol) \(\underrightarrow{t^o}\) 3CO2 (3x mol) + 4H2O (4x mol).
2H2S (y mol) + 3O2 (1,5y mol) \(\underrightarrow{t^o}\) 2SO2 (y mol) + 2H2O (y mol).
b) Số mol nước và hỗn hợp khí Y lần lượt là 12,6/18=0,7 (mol) và 13,44/22,4=0,6 (mol).
Gọi x (mol) và y (mol) lần lượt là số mol của C3H8 và H2S.
Số mol nước: 4x+y=0,7 (1).
Số mol Y: 3x+y=0,6 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra x=0,1 (mol) và y=0,3 (mol).
V=(5x+1,5y).22,4=(5.0,1+1,5.0,3).22,4=21,28 (lít).
c. m=0,1.44+0,3.34=14,6 (g).
Kiểm tra: MY=(3.0,1.44+0,3.64)/0,6=54 (g/mol) (thỏa).
d. MX=14,6/(0,1+0,3)=36,5 (g/mol).
dX/\(H_2\)=36,5/2=18,25.
Đúng 1
Bình luận (2)
1) Đốt cháy hoàn toàn chất X bằng lượng khí Oxi vừa đủ, ta thu được hỗn hợp khí duy nhất là CO2 và SO2, hỗn hợp khí này có tỉ khối đối với khí hidro bằng 28,667. Xác định công thức phân tử của X, biết tỉ khối hơi của X so với không khí nhỏ hơn 3.2) Cho 2,3g Na vào 100g dd NaOH 10%. Tính nồng độ % và nồng độ mol/lít của dd mới. Biết khối lượng riêng của dd mới là 1,05g/ml.Giúp mk ạ.
Đọc tiếp
1) Đốt cháy hoàn toàn chất X bằng lượng khí Oxi vừa đủ, ta thu được hỗn hợp khí duy nhất là CO2 và SO2, hỗn hợp khí này có tỉ khối đối với khí hidro bằng 28,667. Xác định công thức phân tử của X, biết tỉ khối hơi của X so với không khí nhỏ hơn 3.
2) Cho 2,3g Na vào 100g dd NaOH 10%. Tính nồng độ % và nồng độ mol/lít của dd mới. Biết khối lượng riêng của dd mới là 1,05g/ml.
Giúp mk ạ.
Hỗn hợp khí X gồm metan, etilen và propin có tỉ khối so với H2 bằng 14. Đốt cháy hoàn toàn hỗn hợp X cần dùng V lít khí O2 (đktc), thu được CO2 và 3,6 gam nước. Giá trị của V là A. 3,36 B. 4,48 C. 6,72 D. 2,24
Đọc tiếp
Hỗn hợp khí X gồm metan, etilen và propin có tỉ khối so với H2 bằng 14. Đốt cháy hoàn toàn hỗn hợp X cần dùng V lít khí O2 (đktc), thu được CO2 và 3,6 gam nước. Giá trị của V là
A. 3,36
B. 4,48
C. 6,72
D. 2,24
Chọn C.
Đặt CTTQ của X là CxH4 Þ 12x + 4 = 28 Þ x = 2
Khi đốt cháy X thu được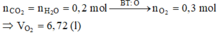
Đúng 0
Bình luận (0)
Hỗn hợp khí X gồm metan, etilen và propin có tỉ khối so với H2 bằng 14. Đốt cháy hoàn toàn hỗn hợp X cần dùng V lít khí O2 (đktc), thu được CO2 và 3,6 gam nước. Giá trị của V là A. 3,36 B. 4,48 C. 6,72 D. 2,24
Đọc tiếp
Hỗn hợp khí X gồm metan, etilen và propin có tỉ khối so với H2 bằng 14. Đốt cháy hoàn toàn hỗn hợp X cần dùng V lít khí O2 (đktc), thu được CO2 và 3,6 gam nước. Giá trị của V là
A. 3,36
B. 4,48
C. 6,72
D. 2,24
Đốt cháy hoàn toàn 0,1 mol khí CxHy cần 6,72 lít khí oxi (ở đktc). Sau phản ứng thu được 8,8 gam khí cacbonic và 3,6 gam nước. Tính Khối lượng mol và xác định công thức hóa học của CxHy, biết tỉ lệ giữa x và y là 1:2.
$n_{CO_2} = \dfrac{8,8}{44} = 0,2(mol) ; n_{H_2O} = \dfrac{3,6}{18} = 0,2(mol)$
$C_xH_y + (x + \dfrac{y}{4})O_2 \xrightarrow{t^o} xCO_2 + \dfrac{y}{2}H_2O$
Theo PTHH :
$0,1.x = 0,2$ và $0,1.\dfrac{y}{2} = 0,2$
Suy ra : x = 2 ; y = 4
Vậy CTHH cần tìm là $C_2H_4$(M = 28)
Đúng 0
Bình luận (0)
Đốt cháy hết m gam hỗn hợp gồm CH4,C2H4 và CxHy sau phản ứng thu được sản phẩm gồm 15,68 lít khí CO2 ở đktc và 9 gam nước. Tính m
Ta có: \(n_{CO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=0,5.2=1\left(mol\right)\)
\(\Rightarrow m=m_C+m_H=0,7.12+1.1=9,4\left(g\right)\)
Đúng 3
Bình luận (0)