Phân biệt khi nào sắt có hoá trị 2,3
Thầy mình nói Sắt tác dụng với dd muối và axit thì mang hoá trị 2 đều đó có hoàn toàn đúng hay không
Khi sắt tác dụng với các phi kim khác thì mang hoá trị nào
cho 11,2g sắt tác dụng với 43,8g axit clohidric sau phản ứng thu được dung dịch muối và V lít khí hidro đktc. Tính giá trị V b, để khử hoàn toàn 36g oxit một kim loại hoá trị 2 cần đung 11,2 lít khi h2 đktc. Tìm CTHH của oxit trên cho: Fe=5,6 O=16 H=1 Cl=35,5 Mọi người giúp em vs ạ
Câu 1:
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{HCl}=\dfrac{43,8}{36,5}=1,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{1,2}{2}\) \(\Rightarrow\) HCl còn dư, Fe p/ứ hết
\(\Rightarrow n_{H_2}=0,2\left(mol\right)\) \(\Rightarrow V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\)
Câu 2:
PTHH: \(RO+H_2\underrightarrow{t^o}R+H_2O\)
Ta có: \(n_{RO}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow\dfrac{36}{M_R+16}=0,5\) \(\Rightarrow M_R=56\) (Sắt)
Vậy CTHH cần tìm là FeO
Khi cho oxit của một kim loại hoá trị n tác dụng với dung dịch N H O 3 dư thì tạo thành 34,0 g muối nitrat và 3,6 g nước (không có sản phẩm khác). Hỏi đó là oxit của kim loại nào và khối lượng của oxit kim loại đã phản ứng là bao nhiêu ?
Phản ứng chỉ tạo ra muối nitrat và nước, chứng tỏ n là hoá trị duy nhất của kim loại trong oxit. Đặt công thức của oxit kim loại là M 2 O n và nguyên tử khối của M là A.
Phương trình hoá học :
M 2 O n + 2n H N O 3 → 2 M ( N O 3 ) n + n H 2 O (1)
Theo phản ứng (1), khi tạo thành 1 mol [tức (A + 62n gam)] muối nitrat thì đồng thời tạo thành 0,5 mol (tức 9n gam) nước.
(A + 62n) gam muối nitrat - 9n gam nước
34 gam muối nitrat - 3,6 gam nước
Ta có tỉ lệ: 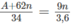
Giải phương trình được A = 23n. Chỉ có nghiệm n = 1, A = 23 là phù hợp. Vậy kim loại M trong oxit là natri.
Phản ứng giữa Na2O và HNO3:
Na2O + 2HNO3 → 2NaNO3 + H2O (2)
Theo phản ứng (2) :
Cứ tạo ra 18 gam H2O thì có 62 gam Na2O đã phản ứng
Vậy tạo ra 3,6 gam H2O thì có x gam Na2O đã phản ứng
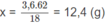
Khi cho sắt tác dụng với các chất sau, chất nào oxi hoá sắt thành Fe3+?
A. HCl
B. H2SO4 loãng, nguội
C. HCl đặc, nóng
D. Cl2
Khi cho sắt tác dụng với các chất sau, chất nào oxi hoá sắt thành Fe3+?
A. HCl.
B. H2SO4 loãng, nguội.
C. HCl đặc, nóng.
D. Cl2.
Giúp mình nhak mấy bạn
Cho 16g oxit sắt có công thúc hoá học là FexOy tác dụng với 120ml dd HCl thì thu được 32,5g muối khan. Xác định công thức goá học của oxit sắt.
PTPƯ:
FexOy + 2yHCI -------------> xFeCI2y/x +yH2O
1mol ----------------------------> xmol
16/(56x +16y)mol-------------> 32,5/(56 + 71y/x)
=> 16x/(56x + 16y) = 32,5/(56 + 71y/x)
=> 896x +1136y = 1820x + 520y
=>616y = 924x
=> x/y = 2/3
Vậy CT của oxít sắt là Fe2O3
Cho 1,4g kim loại có hoá trị 2 hoặc 3 tác dụng với dd h2so4 loãng thu đc 3,8g muối. Xác định tên kim loại đó
Giả sử KL có hóa trị n.
Ta có: mKL + mSO4 = m muối
⇒ mSO4 = 2,4 (g) \(\Rightarrow n_{H_2}=n_{H_2SO_4}=n_{SO_4}=\dfrac{2,4}{96}=0,025\left(mol\right)\)
BT e, có: n.nKL = 2nH2 \(\Rightarrow n_{KL}=\dfrac{0,05}{n}\left(mol\right)\)
\(\Rightarrow M_{KL}=\dfrac{1,4}{\dfrac{0,05}{n}}=28n\left(g/mol\right)\)
Với n = 2 thì M = 56 (g/mol) là thỏa mãn.
Vậy: KL cần tìm là sắt (Fe).
Cho a mol sắt tác dụng với dung dịch HNO3 loãng (có chứa 3a mol HNO3). Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và khí B không màu hoá nâu ngoài không khí. Biết B là sản phẩm duy nhất của sự khử . Phát biểu nào sau đây sai:
A. Dung dịch A chứa hai muối
B. Trong thí nghiệm trên đã xảy ra tất cả 4 phản ứng
C. Dung dịch A có khả năng phản ứng với cả Cu và Cl2
D. Khi cho HCl vào dung dịch A thấy có khí B tiếp tục bay lên
Đáp án B
Định hướng tư duy giải
Khi cho a mol Fe pứ với dung dịch chứa 3a mol HNO3
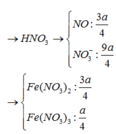

cho 5,6g kim loại sắt tác dụng hoàn toàn với dung dịch axit clohidric thu được m gam muối sắt clorua và V lít khí hidro ở đktc
a xác định m và V
b nếu cho V lít khí hidro thu được ở trên tác dụng với 4g đồng oxit thì chất nào còn dư và dư bn
nFe = 5,6 : 56 = 0,1(mol)
pthh : Fe + 2 HCl -->FeCl2 + H2
0,1---------------> 0,1-----> 0,1 (mol)
=> m = mFeCl2 = 0,1 .127 = 12,7 (g)
=> V = VH2 (dktc ) = 0,1 . 22,4 = 2,24 (l)
nCuO = 4 : 80 0,05 (mol)
pthh CuO + H2 -t--> Cu + H2O
LTL : 0,05/ 1 < 0,1 /1 => H2 du
nH2(pu) = nCuO = 0,05 (mol)
=> nH2 (du) = nH2 (ban dau ) - nH2 (pu )
= 0,1 - 0,05 = 0,05 (mol)
mH2(du) = 0,05 . 2 = 0,1 (g)
Fe + 2HCl ---> FeCl2 + H2
0,1 -> 0,2 -> 0,1 -> 0,1 (mol)
nFe = \(\dfrac{5,6}{56}\)= 0,1 (mol)
mFeCl2 = 0,1 . (56 + 35,5 . 2) = 12,7 (g)
VH2 = 0,1 . 22,4 = 2,24 (l)
b) H2 + CuO --> Cu + H2O
0,05 <- 0,05 -> 0,05 -> 0,05 (mol)
nCuO = \(\dfrac{4}{80}\)= 0,05(mol)
Tỉ lệ : \(\dfrac{0,1}{1}\) > \(\dfrac{0,05}{1}\). Vậy H2 dư, tính theo CuO.
nH2(dư) = nH2( ban đầu) - nH2(phản ứng) = 0,1 - 0,05 = 0,05 (mol)
Vui lòng kiểm tra lại, nếu có sai sót gì thì sorry.
Cho 2,8 gam kim loại sắt tác dụng hoàn toàn với dung dịch axit HCl. a)Viết phương trình hoá học b)Tính thể tích Hiđro thu được ở điều kiện tiêu chuẩn
\(nFe=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,05 0,05
\(VH_2=0,05.22,4=1,12\left(lít\right)\)