Trình bài cách pha chế 1lit dd H2SO4 0.46M từ dd H2SO4 98% , có khối lượng riêng =1,84g/ml.

Những câu hỏi liên quan
Hãy tính toán và trình bày cách pha chế 0,5lit dung dịch H 2 S O 4 có nồng độ 1mol/l từ H 2 S O 4 có nồng độ 98%, khối lượng riêng là 1,84g/ml.
* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
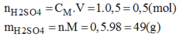
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
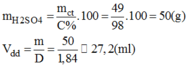
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.
Đúng 1
Bình luận (0)
cách pha 500ml dd ch3cooh 2N từ dd ch2cooh 30% , d = 1,05g
pha 500ml dd Hcl 0,1M từ dung dịch Hcl 36% có d = 1,18g/ml
Pha 500ml dd h2so4 4N từ dd h2so4 98% , d = 1,84g/ml
Từ dd h2so4 98% ( D=1,84g/ml) và dd hcl 5M, làm thế nào pha chế được 200 ml dd H2so4 1M và hcl 1M
nH2SO4 1M là 1.0,2=0,2mol
--->mH2SO4=0,2.98=19,6g
--->mdd H2SO4 98% là 19,6.100/98=20g
thể tích dung dịch H2SO4 98% là 20/1,84≃10,87ml
vậy thể tích nước cần thêm vào là 200-10,87=189,13(ml)
Đúng 0
Bình luận (0)
Cần lấy bao nhiêu ml dd H2SO4 98% ( D= 1,84g/ml ) để pha chế được 4l dd H2SO4 4M
Phần cuối sửa lại:
\(V_{ddH_2SO_498\%}=\frac{1600}{1,84}\approx869,565\left(ml\right)\)
Đúng 0
Bình luận (1)
\(n_{H_2SO_4\cdot4M}=4.4=16\left(mol\right)\\ m_{H_2SO_4\cdot98\%\%}=\frac{\left(16.98\right).100}{98}=1600\left(g\right)\\ V_{H_2SO_4\cdot98\%}=\frac{1600}{1,84}=869,57\left(ml\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Tính toán và trình bày cách pha chế 0,5 lít dd H2SO4 1M từ dd H2SO4 98% có D= 1,84 g/ml
\(n_{H_2SO_4}=0.5\cdot1=0.5\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.5\cdot98\cdot100}{98}=50\left(g\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{50}{1.84}=27.17\left(ml\right)=0.02717\left(l\right)\)
Đúng 4
Bình luận (0)
Sorry chút nhé , đọc thiếu đề.
Cách pha chế :
- Đong lấy 100 ml nước cất cho vào bình đựng có dung tích 1 (l) , cho từ từ 50 (g) dung dịch H2SO4 vào cốc. Rót từ từ nước cất đến vạch 0.5 (l) thì dừng lại.
Đúng 3
Bình luận (1)
Tính thể tích dd H2SO4 98% (d = 1,83g/ml) cần dùng để pha đc 500ml dd H2SO4 0,1M. Nêu cáCh pha chế dd trên.
n H2SO4 = 0,5.0,1 = 0,05(mol)
m H2SO4 = 0,05.98 = 4,9(gam)
m dd H2SO4 = \(\dfrac{4,9}{98\%}\) = 5(gam)
V dd H2SO4 = \(\dfrac{5}{1,83}\) = 2,7322(cm3)
Đúng 2
Bình luận (1)
Cần bao nhiêu gam và bao nhiêu lít dd H2SO4 nồng độ 38% ( tỉ khối bằng 1,29) và dd H2SO4 96% (khối lượng riêng= 1,84g/ml) để pha trộn thành 4lít dd H2SO4 40% ( khối lượng riêng= 1,31g/ml)
người ta pha 150g dd H2SO4 30%vào 50ml dd h2so4 1M (có khối lượng riêng D=1,07g/ml).tính nồng độ phần trăm dd thu đc
Ta có: \(m_{H_2SO_4}=150\cdot30\%+0,05\cdot1\cdot98=49,9\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{49,9}{150+50\cdot1,07}\cdot100\%\approx24,52\%\)
Đúng 1
Bình luận (0)
Hãy tính toán và bày cách pha chế 150g dd H2SO4 20% từ dd H2SO4 98%
\(m_{H_2SO_4}=\dfrac{150.20}{100}=30\left(g\right)\\ \rightarrow m_{ddH_2SO_4\left(98\%\right)}=\dfrac{30.100}{98}=30,6\left(g\right)\\ \rightarrow m_{H_2O\left(thêm\right)}=150-30,6=119,4\left(g\right)\)
\(\rightarrow V_{H_2O}=\dfrac{119,4}{1}=119,4\left(ml\right)\)
Các pha chế: Rót từ 30,6 g dd H2SO4 đặc (98%) và cốc có đựng sẵn 119,4 ml nước rồi khuấy đều, nếu làm nhược lại sẽ nguy hiểm
Đúng 2
Bình luận (0)


























