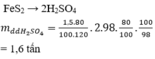tính khối lượng quặng boxit chứa 70% Al2 O3 để điều chế 2,7 tấn nhôm và hiệu suất 80%

Những câu hỏi liên quan
Người ta điều chế Al từ một loại quặng có chứa 80% Al2 O3 . Biết hiệu suất của phản ứng đạt 75%. Khối lượng quặng để điều chế ra 5,4 tấn nhôm là
\(PTHH:2Al_2O_3\rightarrow4Al+3O_2\)
Cứ \(204\)tấn\(Al_2O_3\)tham gia pứ thì thu được \(108\) tấn \(Al\)
\(\Rightarrow\)Để thu được \(5,4\) tấn \(Al\) cần \(10,2\)tấn \(Al_2O_3\)
Vì: \(H=75\%\Rightarrow m_{Al_2O_3}=\frac{10,2.100}{75}=13,6\)(Tấn)
Mà quặng chỉ chứa\(80\%Al_2O_3\)
\(\Rightarrow\) Khối lượng quặng để điều chế\(5,4\)tấn \(Al\) là:
\(m_{quặng}=\frac{13,6.100}{80}=17\)(Tấn)
Vậy ......
để có được 2,7 tấn nhôm nguyên chất cần bao nhiêu tấn quặng boxit chứa 80% nhôm oxit. Biết hiệu suất H của quá trình là 90%
2,7 tấn = 2700 kg
$n_{Al} = \dfrac{2700}{27} = 100(kmol)$
$\Rightarrow n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 50(kmol)$
$m_{Al_2O_3} = 50.102 = 5100(kg)$
$\Rightarrow m_{Al_2O_3\ đã\ dùng} = 5100 : 90\% = 5666,67(kg)$
$\Rightarrow m_{boxit} = 5666,67 : 80\% = 7083,3375(kg)$
Đúng 1
Bình luận (0)
Người ta điều chế Al từ một loại quặng có chứa 80% Al2 O3 . Biết hiệu suất của phản ứng đạt 75%. Khối lượng Al thu được từ 1,02 tấn quặng trên là
Khối lượng nhôm oxit là: \(1,02\cdot80\%=0,816\left(\text{tấn}\right)=816000\left(g\right)\)
\(2Al_2O_3\xrightarrow[.]{t^0}4Al+3O_2\)
\(n_{Al_2O_3}=\frac{816000}{102}=8000\left(mol\right)\)
Theo pt: \(n_{Al}=2n_{Al_2O_3}=16000\left(mol\right)\)
\(n_{Al\left(tt\right)}=16000\cdot75\%=12000\left(mol\right)\)
Ta có: \(m_{Al\left(tt\right)}=12000\cdot27=324000\left(g\right)=0,324\left(\text{tấn}\right)\)
Vậy...
Một loại quặng boxit chứa 48,5% Al2O3. Từ 1 tấn quặng boxit nói trên có thể điều chế được bao nhiêu kilogam nhôm? (Biết hiệu suất của của quá trình điều chế là 90%)
Xem chi tiết
\(m_{Al_2O_3}=1\cdot48,5:100=0,485\left(tấn\right)\\\Rightarrow\dfrac{0,485}{102}=\dfrac{m_{Al\left(100\%\right)}}{27}\\ \Rightarrow m_{Al\left(100\%\right)}=0,128\left(tấn\right)\\ m_{Al\left(90\%\right)}=0,128\cdot90:100=0,1155\left(tấn\right)\)
Đúng 2
Bình luận (1)
Tính khối lượng nhôm cacbua kỹ thuật (chứa 70%Al4C3; còn lại là tạp chất trơ) cần thiết để điều chế được 1 tấn metan. Biết hiệu suất đạt 80%
Ta có :
\(n_{CH_4} = \dfrac{1.1000.1000}{16} = 62500(mol)\)
Phương trình hóa học :
\(Al_4C_3 + 12H_2O \to 4Al(OH)_3 + 3CH_4\)
Theo PTHH :
\(n_{Al_4C_3\ phản\ ứng} = \dfrac{n_{CH_4}}{3} = \dfrac{62500}{3}\ mol\\ n_{Al_4C_3\ đã\ dùng} = \dfrac{\dfrac{62500}{3}}{80\%} = \dfrac{78125}{3}\ mol\)
\(\Rightarrow m_{Al_4C_3} = \dfrac{78125}{3}.144=3750000(gam)\\ \Rightarrow m_{nhôm\ cacbua\ kỹ\ thuật} = \dfrac{3750000}{70\%} = 5357142,9(gam)\)
Đúng 1
Bình luận (0)
Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Tính lượng nhôm thu được khi luyện 0,5 tấn quặng boxit trên. Hiệu suất phản ứng 100%.
Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).
Đúng 0
Bình luận (0)
Tính khối lượng quặng pirit sắt (chứa 80% FeS2) cần dùng để điều chế 9,8 tấn H2SO4. Biết hiệu suất của cả quá trình là 75%.
Để điều chế Cr từ Cr 2 O 3 (tách được từ quặng cromit) người ta dùng phương pháp nhiệt nhôm với hiệu suất 80%. Khối lượng nhôm cần dùng để điều chế 104 gam crom là
A. 54,0 gam
B. 75,6 gam
C. 43,2 gam
D. 67,5 gam
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch
H
2
S
O
4
98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80%
F
e
S
2
(hiệu suất toàn quá trình là 80%) là A. 0,80 tấn B. 1,60 tấn C. 1,25 tấn D. 2,00 tấn
Đọc tiếp
Trong công nghiệp, axit sunfuric được điều chế từ quặng pirit sắt. Khối lượng dung dịch H 2 S O 4 98% điều chế được từ 1,5 tấn quặng pirit sắt có chứa 80% F e S 2 (hiệu suất toàn quá trình là 80%) là
A. 0,80 tấn
B. 1,60 tấn
C. 1,25 tấn
D. 2,00 tấn