hỗn hợp X(Al,Cu) cho 20g X p/ứ hết vs dung dịch HCl thì thấy giải phóng 13,44l. Haỹ cho bt
1. phần trăm mỗi chất trông X
2. KL axit đã p/ứ
3. thể tích O2 ở đktc cần lấy để oxi hóa hết X
Chia 20g hỗn hợp X gồm Al,Fe,Cu thành hai phần bằng.
Phần 1 cho tác dụng hết với dung dịch HCl thu được 5,6 lít khí ở đktc.
Phần 2 cho tác dụng với dung dịch NaOH dư thu được 3,36 lít khí ở đktc
Tính thành phần phần trăm theo khối lượng của Cu trong hỗn hợp X
Phần 1
2Al +6 HCl ----> 2AlCl3 + 3H2 (1)
Fe + 2HCl ----> FeCl2 + H2 (2)
Cu ko pư với dd HCl
Phần 2
2Al + 2NaOH + 2H20 ---> 2NaAlO2 + 3H2 (3)
Fe và Cu ko pư với dd NaOH
Theo pt(3) n Al = \(\frac{2}{3}\).n H2=\(\frac{2}{3}\). \(\frac{3,36}{22,4}\)=0,1 (mol)
%m Al= \(\frac{0,1.27}{20}\).100%= 13,5%
Theo pt(1)(2) tổng n H2=\(\frac{3}{2}\). nAl + n Fe=\(\frac{5,6}{22,4}\)
==> 0,15 + n Fe = 0,25 ==> n Fe = 0,1 (mol)
%m Fe= \(\frac{0,1.56}{20}\).100%= 28%
%m Cu=100% - 13,5% - 28% =58,5%
Cho 12,9gam X là hỗn hợp gồm rượu etylic và axit axetic. Để trung hòa dung dịch X thì cần vừa đủ 50ml dung dịch NaOH 2M
a, Tính thành phần % khối lượng mỗi chất trong hỗn hợp X
b, Tính thể tích O2 ở đktc để đốt cháy hết 12,9gam X
c, Đun nóng lượng X trên với H2SO4 đặc làm xúc tác thu đc 7,04gam este. Tính hiệu suất phản ứng tạo este
cho 27g Al p/ư vs 16,8l O2 ở đktc p/ ứ sau thu đc chất rắn có kl 36,6g. hãy cho bt phần trăm khối lgv mỗi chất có trg chất rắn thu đc sau p/ứ
4Al+ 3O2--->2Al2O3
n\(_{Al}=\frac{27}{27}=1\left(mol\right)\)
n\(_{O2}=\frac{16,8}{22,4}=0,75\left(mol\right)\)
Lập tỉ số
=> K có chất dư sau pư
Vậy chất sau pư chie có Al2O3 ddattj %khối lượng là 100%
nAl = 1(mol)
nO2 = 0,75(mol)
PTHH: 4Al +3O2--->2Al2O3
=> Phần trăm khối lượng mỗi chất sau phản ứng :100%
hỗn hợp X(K, FE). Cho X phản ứng hết với H2O thì thấy giải phóng 4,48l khí ở đktc. Mặt khác để ơphanr ứng hết vs X, ta fai dùng dung dịch có chứa 32,85 g HCl. tính % kl mỗi chất trong X
K 52,7%
Fe 47,3%
Giải thích các bước giải:
K + H2O -> KOH + 1/2 H2
n H2 = 0,2 mol
--> n K = 0,4 mol
n HCl = 0,9 mol
K + HCl -> KCl +1/2 H2
0,4-> 0,4 mol
Fe + 2 HCl -> FeCl2 + H2
0,25 <- 0,5 mol
%mK= 0,4.39÷ (0,4.39 + 0,25.56).100%
= 52,7%
---> %mFe = 47,3%
K + H2O \(\rightarrow\) KOH + \(\frac{1}{2}\) H2
n H2 = 0,2 mol
\(\rightarrow\) \(\text{n K = 0,4 mol}\)
\(\text{n HCl = 0,9 mol}\)
K + HCl \(\rightarrow\) KCl +\(\frac{1}{2}\) H2
0,4___0,4 mol
Fe + 2 HCl \(\rightarrow\) FeCl2 + H2
0,25 ___0,5 mol
%mK= \(\frac{\text{0,4.39}}{\text{0,4.39 + 0,25.56}}\).100%
= 52,7%
\(\rightarrow\) \(\text{%mFe = 47,3%}\)
Hỗn hợp X gồm Al và Cu. Cho 11,8 gam hỗn hợp X vào dung dịch axit clohidric dư thấy thoát ra 6,72 lít khí ở đktc.
a) Viết PTHH
b) Tính thành phần trăm về khối lượng mỗi kim loại trong hỗn hợp X
c) Nếu cho 11,8 gam hỗn hợp X phản ứng hoàn toàn với dung dịch NaOH dư, tính thể tích khí thoát ra ở đktc
a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Cu+HCl\rightarrow\)(không phản ứng)
2Al + 6HCl => 2AlCl3 + 3H2
0,3/3*2 (6,72/22,4)
=> mAl = 0,2 *27 =5,4g; mCu = 11,8 - 5,4 = 6,4g
1,Cho 2,016g kl M có hóa trị không đổi tác dụng hết với oxi, thu được 2,784g chất rắn.Hay xác định kl đó
2,Cho 10,52g hỗn hợp 3 kl ở dạng bột Mg, Al, Cu tác dụng hoàn toàn với oxi, thu được 17,4g hỗn hợp oxit.Hỏi để hòa tan vừa hết lg hỗn hợp oxit đó cần dùng ít nhất bnhieu ml dung dịch HCl 1.25M
1. BT klg=>mO2=2,784-2,016=0,768g
nO2=0,768/32=0,024 mol
GS KL M hóa trị n
4M + nO2 => 2M2On
0,096/n mol<=0,024 mol
=>0,096M=2,016n=>M=21n=>chọn n=8/3=>M=56 Fe
TN1: BT klg=>mO2=17,4-10,52=6,88g
=>nO2=0,215 mol
Quá trình nhận e
$O2$ +4e => 2 $O-2$
0,215 mol=>0,86 mol
n e nhận ko đổi=0,86 mol
TN2 2$H+$ +2e =>H2
0,86 mol<=0,86 mol
Lượng KL vẫn vậy nên n e nhận ko đổi=0,86 mol=nH+=nHCl
=>VddHCl=0,86/1,25=0,688lit
Dẫn 11,2 lít hỗn hợp khí (ở đktc) gồm O2 và O3 đi qua dung dịch KI dư thấy có 31,75 gam chất rắn màu tím đen. Xác định thành phần phần trăm theo thể tích của khí oxi trong hỗn hợp ban đầu. Câu 3. Để oxi hóa hoàn toàn 1,67 gam hỗn hợp Al, Mg và Zn cần V lít khí O2 (ở đktc), sau phản ứng thu được 2,63 gam oxit. Xác định thể tích oxi (V) tham gia phản ứng là. (Biết O = 16; Al = 27; Mg = 24; Zn = 65)
bài 1
H2O+2KI+O3->I2+2KOH+O2
0,25---0,25
n I2=0,25 mol
=>%VO3=\(\dfrac{0,25.22,4}{11,2}100=50\%\\ \)
=>%VO2=50%
bài 2
BTKLg:
m O2=2,63-1,67=0,96g
=>n O2=0,03 mol
=>VO2=0,03.22,4=0,672l
`H2O + 2KI + O3 -> I2 + 2KOH + O2`
`0,25 ----- 0,25`
`n l2 = 0,25` `mol`
`=> %VO3 = (0,25 . 22,4)/(11,2) . 100 = 50%`
`=> $ VO2 = 50%`
_________________________________
`m O2 = 2,63 - 1,67 = 0,96 g`
`=> n O2 = 0,03` `mol`
`=>` `VO2 = 0,03 . 22,4 = 0,672l`
Hỗn hợp X gồm Fe và Cu. Cho 25g X phản ứng hết với dung dịch HCl 14,6% thì thấy giải phóng 6,72l khí H2 ở đktc. hãy cho biết:
a, % khối lượng mỗi chất trong X -
b, khối lượng HCl đã dùng -
c, Nồng độ phần trăm dung dịch sau phản ứng
nH2 = 0,3 mol
- Cu không phản ứng với HCl
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
\(\Rightarrow\) mFe = 0,3.56 = 16,8 (g)
\(\Rightarrow\) mCu = 25 - 16,8 = 8,2 (g)
\(\Rightarrow\) mHCl đã dùng = \(\dfrac{0,3.36,5.100}{14,6}\) = 75 (g)
\(\Rightarrow\) mdd sau phản ứng = 25 + 75 - ( 0,3.2 ) - 8,2 = 91,2 (g)
\(\Rightarrow\) C% = \(\dfrac{0,3.127.100}{91,2}\) = 41,77%
Hidrat hóa hỗn hợp etilen và propilen có tỉ lệ mol 1 : 3 khi có mặt axit H2SO4 loãng thu được hỗn hợp ancol X. Lấy m gam hỗn hợp ancol X cho tác dụng hết với Na thấy bay ra 448 ml khí (đktc). Oxi hóa m gam hỗn hợp ancol X bằng O2 không khí ở nhiệt độ cao và có Cu xúc tác được hỗn hợp sản phẩm Y. Cho Y tác dụng với AgNO3 trong NH3 dư thu được 2,808 gam bạc kim loại. Phần trăm số mol propan – 1 – ol trong hỗn hợp là ?
A. 25%.
B. 12,5%.
C. 7,5%.
D. 75%.
Đáp án : C
Ta có : m gam X là
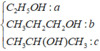
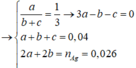
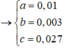
⇒ %CH3CH2CH2OH = 7,5%