Cho hỗn hợp. Fe FeO FeCO3 tác dụng vừa đủ với 200ml dd H2SO4 loãng. Được 15.2g muối sunfat. Tính Cm dd axit đã dùng

Những câu hỏi liên quan
Để tác dụng vừa đủ với 44,8 gam hỗn hợp gồm FeO , Fe2O3 , Fe3O4 cần phải dùng 400ml dd axit sunfuric 2M ( loãng ) sau phản ưng thu được m gam hỗn hộp muối sunfat . Tính m
\(n_{H_2SO_4}=2.0,4=0,8\left(mol\right)\)
PTHH: \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\left(1\right)\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\left(2\right)\)
\(Fe_3O_4+4H_2SO_4\rightarrow Fe\left(SO_4\right)_3+FeSO_4+4H_2O\left(3\right)\)
Theo (3) ta có: \(n_{H_2O}=n_{H_2SO_4}=0,8\left(mol\right)\)
Theo định luật bảo toàn kl:
\(m_{hh}+m_{H_2SO_4}=m_{muốisunfat}+m_{H_2O}\)
\(\Rightarrow m_{muôisunfat}=m_{hh}+m_{H_2SO_4}-m_{H_2O}=44,8+0,8.98-0,8.18=108,8\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 35,2gam hỗn hợp X gồm Fe và CuO tác dụng vừa đủ với 800 gam dd H2SO4 loãng thì thu dc 4,48 lít khí ( đkc) và dung dịch A
a)tính% khối lượng mỗi chất trong X
b)tính C% dd H2SO4 đã dùng
c) tính khối lượng các muối trong dd A
Đáp số: a.Fe:31,82%. ; CuO:68,18%
b.C%=6,125
c.mFeSO4=30,4g; mCuSO4=48g
Xem chi tiết
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(m_{CuO}=35.2-0.2\cdot56=24\left(g\right)\)
\(n_{CuO}=\dfrac{24}{80}=0.3\left(mol\right)\)
\(\%Fe=\dfrac{11.2}{35.2}\cdot100\%=31.82\%\)
\(\%CuO=100-31.82=68.18\%\)
\(n_{H_2SO_4}=0.2+0.3=0.5\left(mol\right)\)
\(m_{H_2SO_4}=0.5\cdot98=49\left(g\right)\)
\(C\%H_2SO_4=\dfrac{49}{800}\cdot100\%=6.125\%\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(m_{CuSO_4}=0.3\cdot160=48\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 30,8g hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO, MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 7,84l khí (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4g hỗn hợp muối sunfat trung hòa. Tỉ khối Y so với He là 6,5. Khối lượng của MgSO4 trong dung dịch Z là A. 38,0g B. 33,6g C. 36,0g D. 30,0g
Đọc tiếp
Cho 30,8g hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO, MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng thu được 7,84l khí (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4g hỗn hợp muối sunfat trung hòa. Tỉ khối Y so với He là 6,5. Khối lượng của MgSO4 trong dung dịch Z là
A. 38,0g
B. 33,6g
C. 36,0g
D. 30,0g
Đáp án : D
nY = 0,35 mol ; MY = 26g => nCO2 = 0,2 ; nH2 = 0,15 mol
Gọi số mol H2O là x
Bảo toàn H : nH2SO4 = nH2O + nH2 = (x + 0,15)
Bảo toàn khối lượng : mX + mH2SO4 = mmuối + mCO2 + mH2 + mH2O
=> 30,8 + 98.(x + 0,15) = 60,4 + 26.0,35 + 18x
=> x = 0,3 mol
Trong hỗn hợp muối chỉ có a mol MgSO4 và b mol FeSO4
=> mmuối = 120a + 152b = 60,4
,nSO4 = a + b = 0,45
=> a = 0,25 ; b = 0,2 mol
=> mMgSO4 = 30g
Đúng 0
Bình luận (0)
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của FeSO4 trong dung dịch Z là A. 22,4 gam. B. 30,4 gam. C. 26,8 gam. D. 30,0 gam.
Đọc tiếp
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của FeSO4 trong dung dịch Z là
A. 22,4 gam.
B. 30,4 gam.
C. 26,8 gam.
D. 30,0 gam.
Đáp án B
Dùng phương pháp đường chéo tính được mol CO2 là 0,2 mol và H2 là 0,15 mol.
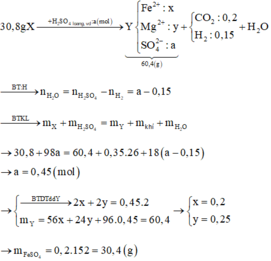
Đúng 0
Bình luận (0)
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là A. 38,0 gam. B. 33,6 gam. C. 36,0 gam. D. 30,0 gam.
Đọc tiếp
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là
A. 38,0 gam.
B. 33,6 gam.
C. 36,0 gam.
D. 30,0 gam.
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là: A. 38,0 gam. B. 33,6 gam. C. 36,0 gam. D. 30,0 gam.
Đọc tiếp
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là:
A. 38,0 gam.
B. 33,6 gam.
C. 36,0 gam.
D. 30,0 gam.
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là A. 30,0 gam. B. 33,6 gam. C. 36,0 gam. D. 38,0 gam.
Đọc tiếp
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là
A. 30,0 gam.
B. 33,6 gam.
C. 36,0 gam.
D. 38,0 gam.
Đáp án A
+ n C O 2 + n H 2 = 0 , 35 44 n C O 2 + 2 n H 2 = 4 . 6 , 5 . 0 , 35 = 9 , 1 ⇒ n C O 2 = 0 , 2 n H 2 = 0 , 15 + F e , F e C O 3 F e O , M g O M g , M g C O 3 → q u y đ ổ i F e ( x m o l ) M g ( y m o l ) O ( z m o l ) , C O 2 → H 2 S O 4 M g S O 4 F e S O 4 + H 2 C O 2 ⇒ 56 x + 24 y + 16 z = 30 , 8 - 0 , 2 . 44 = 22 152 x + 120 y = 60 , 4 B T E : 2 x + 2 y = 2 z + 0 , 15 . 2 ⇒ x = 0 , 2 y = 0 , 25 z = 0 , 3 ⇒ m M g S O 4 = 30 g a m
Đúng 0
Bình luận (0)
cho 8 gam hỗn hợp Cuo và Fe2o3 tác dụng vừa đủ với 200ml dd Hcl thu được dd X hai muối có tỉ lệ 1:1
a) Tính khối lượng axit trong hỗn hợp
b) Tính CM dd HCl
a, Ta có
CuO + 2HCl \(\rightarrow\) CuCl2 + H2O
x \(\rightarrow\) 2x \(\rightarrow\) x \(\rightarrow\) x
Fe2O3 + 6HCl \(\rightarrow\) 2FeCl3 + 3H2O
y \(\rightarrow\) 6y \(\rightarrow\) 2y \(\rightarrow\) 3y
Theo 2 phương trình trên ta có
nCuCl2 / nFeCl3 = 1/1 => x / 2y = 1/1
=> x = 2y => x - 2y = 0
=> \(\left\{{}\begin{matrix}80x+160y=8\\\text{x - 2y = 0}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,05\\y=0,025\end{matrix}\right.\)
=> MHCl = ( 2x + 6y ) . 36,5 = 9,125 ( gam )
b, 200 ml = 0,2 l
=> CM HCl = n : V = ( 2x + 6y ) : 0,2 = 1,25 M
Đúng 0
Bình luận (0)
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan. Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.a. Viết các PTHH xảy ra.b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.c. Tính CM dd Q.
Đọc tiếp
Hỗn hợp Z gồm FeO, Fe3O4 , Fe2O3 . Lấy 100 g Z chia làm 2 phần bằng nhau.
Cho phần thứ nhất tác dụng với dd H2SO4 loãng dư thu được 118 g muối khan.
Phần 2 tác dụng vừa đủ 400ml dd Q chứa 2 chất tan là HCl, H2SO4 loãng thu được 111,75 g muối khan.
a. Viết các PTHH xảy ra.
b. Tính % khối lượng nguyên tố Fe trong hỗn hợp Z.
c. Tính CM dd Q.













