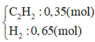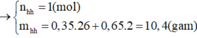Cho 1 mol N2 và 4 mol H2 vào bình phản ứng, sau một thời gian thu được 3,5 mol hỗn hợp khí

Những câu hỏi liên quan
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau thời gian phản ứng, áp suất của các khí trong bình giảm 5% so với áp suất lúc đầu. Biết rằng tỷ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 và H2 trong hỗn hợp đầu. A. %
V
N
2
25%; %
V
H
2
75% B. %...
Đọc tiếp
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau thời gian phản ứng, áp suất của các khí trong bình giảm 5% so với áp suất lúc đầu. Biết rằng tỷ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 và H2 trong hỗn hợp đầu.
A. % V N 2 = 25%; % V H 2 = 75%
B. % V N 2 = 30%; % V H 2 = 70%
C. % V N 2 = 22,5%; % V H 2 = 77,5%
D. % V N 2 = 20%; % V H 2 = 80%
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là: A. 15% và 85% B. 82,35% và 77,5% C. 25% và 75% D. 22,5% và 77,5%
Đọc tiếp
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85%
B. 82,35% và 77,5%
C. 25% và 75%
D. 22,5% và 77,5%
Đáp án C
Giả sử có 1 mol hỗn hợp đầu. Gọi x và y (mol) lần lượt là số mol của N₂ và H₂ trong 1 mol hỗn hợp đầu
Gọi n₁, P₁ và n₂, P₂ lần lượt là số mol hỗn hợp khí + áp suất trong bình ban đầu và lúc sau
⇒ n₁ = x + y = 1 (1)
Khi nhiệt độ không đổi
⇒ n₁ / n₂ = P₁ / P₂
Áp suất khí trong bình giảm 5% so với áp suất ban đầu ⇒ P₁ / P₂ = 20 / 19
⇒ n₁ / n₂ = 20 / 19 (2)
Số mol của nito đã phản ứng là 10% ⇒ N₂ pứ 0,1x mol
N₂ + 3H₂ → 2NH₃
Trước: x y 0
Pứ 0,1x 0,3x 0,2x
Sau: n N₂ = 0,9x ; n H₂ = y - 0,3x ; n NH₃ = 0,2x
⇒ n₂ = 0,9x + y - 0,3x + 0,2x
⇒ n₂ = 0,8x + y (3)
Từ (1) (2) & (3) ta có:
(x + y) / (0,8x + y) = 20 / 19
⇒ 3x - y = 0 (4)
Giải hệ (1) & (4) cho ta: x = 0,25 mol và y = 0,75 mol
Thành phần phần trăm về số mol của N₂ và H₂ trong hỗn hợp đầu là:
%N₂ = 25% và %H₂ = 75%
Đúng 0
Bình luận (0)
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là: A. 15% và 85% B. 82,35% và 77,5% C. 25% và 75% D. 22,5% và 77,5%.
Đọc tiếp
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau một thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết tỉ lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu là:
A. 15% và 85%
B. 82,35% và 77,5%
C. 25% và 75%
D. 22,5% và 77,5%.
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau một thời gian phản ứng, áp suất của các khí trong bình giảm 10% so với áp suất ban đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 trong hỗn hợp đầu? A. 50% B. 49% C. 47% D. 48%
Đọc tiếp
Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau một thời gian phản ứng, áp suất của các khí trong bình giảm 10% so với áp suất ban đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 trong hỗn hợp đầu?
A. 50%
B. 49%
C. 47%
D. 48%
Cho 9 mol N2 và 6 mol H2 vào bình tổng hợp thu được khí NH3. Tính thànhphần % theo thể tích của các khí có trong hỗn hợp sau phản ứng và hiệu suất phản ứng. Biết rằng hỗn hợp sau phản ứng có tổng số mol là 14
\(N_2+3H_2\leftrightarrow2NH_3\\ n_{NH_3}=a\left(mol\right)\\ n_{sau}=14=9-\dfrac{1}{2}a+6-\dfrac{3}{2}a+a\\ a=1\\ n_{N_2}:1>n_{H_2}:3\\ H=\dfrac{1}{\dfrac{2}{3}.6}.100\%=25\%\)
Đúng 1
Bình luận (0)
Cho V lít (đktc) hỗn hợp khí
N
2
và
H
2
có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol
NH
3
. Biết hiệu suất phản ứng là H 25%. Giá trị của V là A. 42 lít. B. 268,8 lít. C. 336 lít. D. 448 lít.
Đọc tiếp
Cho V lít (đktc) hỗn hợp khí N 2 và H 2 có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol NH 3 . Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít.
B. 268,8 lít.
C. 336 lít.
D. 448 lít.
Chọn C
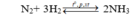
Giả sử phản ứng xảy ra với H = 100% → N 2 hết →Hiệu suất tính theo N 2 .
Đặt số mol N 2 ban đầu là x mol, n N 2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên n N 2 pứ = 25%.x = 0,25x mol
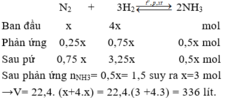
Đúng 1
Bình luận (0)
Trong một bình kín chứa 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni, đun nóng bình 1 thời gian, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 8. Sục X vào lượng dư dung dịch AgNO3 trong NH3 đến phản ứng hoàn toàn, thu được hỗn hợp khí Y và 12 gam kết tủa. Hỗn hợp khí Y phản ứng vừa đủ với bao nhiêu mol Br2 trong dung dịch. A. 0,25 mol . B. 0,20 mol. C. 0,15 mol. D. 0,10 mol.
Đọc tiếp
Trong một bình kín chứa 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni, đun nóng bình 1 thời gian, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 8. Sục X vào lượng dư dung dịch AgNO3 trong NH3 đến phản ứng hoàn toàn, thu được hỗn hợp khí Y và 12 gam kết tủa. Hỗn hợp khí Y phản ứng vừa đủ với bao nhiêu mol Br2 trong dung dịch.
A. 0,25 mol .
B. 0,20 mol.
C. 0,15 mol.
D. 0,10 mol.
Trong một bình kín chứa 8 mol khí H2 và 3 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian tới khi có 60% thể tích H2 phản ứng thì thu được hỗn hợp khí A (gồm N2, H2 và NH3).
a/ Tính thể tích NH3 tạo thành (đktc).
b/ Tính tỉ khối của A đối với H2.
a) \(N_2+3H_2-^{t^o}\rightarrow2NH_3\)
3..........8
Lập tỉ lệ \(\dfrac{3}{1}>\dfrac{8}{3}\) => Tính theo số mol H2
\(n_{H_2\left(pứ\right)}=8.60\%=4,8\left(mol\right)\)
=> \(n_{NH_3}=\dfrac{4,8.2}{3}=3,2\left(mol\right)\)
=> \(V_{NH_3}=3,2.22,4=71,68\left(l\right)\)
b) Hỗn hợp A gồm N2 dư, H2 dư, NH3
\(n_{N_2\left(dư\right)}=3-\dfrac{4,8}{3}=1,4\left(mol\right)\)
\(n_{H_2\left(dư\right)}=8-4,8=3,2\left(mol\right)\)
\(M_A=\dfrac{3,2.2+1,4.28+3,2.17}{3,2+1,4+3,2}=12,82\)
=>dA/H2 \(=\dfrac{12,82}{2}=6,41\)
Đúng 2
Bình luận (0)
Trong một bình kín chứa 4 mol khí H2 và 2 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian thì thu được hỗn hợp khí A.a/ Nếu hiệu suất phản ứng đạt 75% thì có bao nhiêu lít khí NH3 tạo thành (đktc) .b/ Nếu tổng số mol các khí trong hỗn hợp A là 4,5 mol thì có bao nhiêu % số mol H2 bị oxi hoá thành NH3.
\(N_2+3H_2\rightarrow2NH_3\)
So sánh:
\(\dfrac{n_{N_2}}{1}=2>\dfrac{n_{H_2}}{3}=1,333\)
-> Tính theo H2
\(n_{H_2}pư=75\%.4=3\left(mol\right)\)
\(\rightarrow n_{NH_3}=2\left(mol\right)\)
\(\rightarrow V_{NH_3}=2.22,4=44,8\left(l\right)\)
b. \(N_2+3H_2\rightarrow2NH_3\)
Bđ : 2 ..... 4 ..........
Pứ : a ....... 3a ........ 2a
Sau: (2-a) : (4-3a) : 2a
2-a+4-3a+2a = 4,5
=> a = 0,75 (mol)
%nH2 bị oxh = \(\dfrac{3.0,75}{4}.100\%=56,25\%\)
Đúng 3
Bình luận (0)




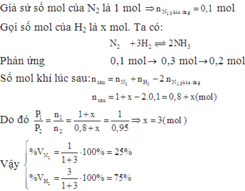
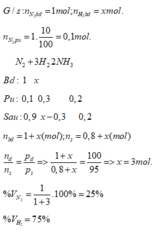
 A.
A.