Nung bột Fe với bột S ở nhiệt độ cao.Khi lượng bột S tăng 50% khối lượng thì dừng.
a) Tính hiệu suất phản ứng
b) Tính % khối lượng mỗi chất có trong hỗn hợp sau phản ứng
nhiệt phân 87,7 gam hỗn hợp gồm KMnO4 và KClO3. phản ứng thu được chất rắn A có khối lượng 74,9 gam. biết H hai phản ứng là 80%. a) tính khối lượng mỗi chất có trong hỗn hợp đầu b) tính khối lượng từng chất trong A
hòa tan hoàn toàn 13,2(g) hỗn hợp hai bột ZnO và Al2O3 vào 250 (ml) dung dịch HCl 2M (vừa đủ)
a) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp
b) tính nồng độ mol của các muối trong dung dịch sau phản ứng (thể tích dung dịch thay đổi không đáng kể)
Cho m gam bột sắt tác dụng hoàn toàn với dung dịch HCl 10% thu được 1,12lit khí hidro ( ở đktc )
a , Viết PTHH của phản ứng trên
b , Tính khối lượng bột sắt ( m )
c , Tính khối lượng dung dịch HCl cần dùng ( Biết : Fe = 56 ; H=1 )
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.05......0.1...................0.05\)
\(m_{Fe}=0.05\cdot56=2.8\left(g\right)\)
\(m_{dd_{HCl}}=\dfrac{0.1\cdot36.5\cdot100}{10}=36.5\left(g\right)\)
Thủy phân 324 gam tinh bột với hiệu suất của phản ứng 75% thì khối lượng glucozơ thu được là:
A. 360 gam
B. 270 gam
C. 300 gam
D. 250 gam
dẫn 36 khối lượng khí gồm CO và H2 đi từ từ qua 139,2g bột Fe3O4 đun nóng ở nhiệt độ cao thu được m(g) sắt và 74,4g hỗn hợp gồm CO2 và H2O. Tính m biết phản ứng xảy ra vừa đủ.
Khối lượng bột nhôm cần dùng để thu được 65 gam crom từ C r 2 O 3 bằng phản ứng nhiệt nhôm (giả sử hiệu suất phản ứng là 100%) là
A. 40,5 gam.
B. 67,5 gam.
C. 33,75 gam.
D. 54,0 gam.
cho 5gam hỗn hợp bột bạc và đồng vào dung dịch AgNo3 dư , phản ứng hoàn toàn , thu 8,8 gam chất rắn . Tính thành phần trăm về khối lượng của đồng trong hỗn hợp ban đầu ?
Ag + AgNO3 (không phản ứng)
Cu + 2AgNO3 -> 2Ag +Cu(NO3)2
0.04 0.08
n(Ag)=8.8/108=0.08 mol
m(Cu)=0.04*64=2.56(g)
%m(Cu)=(2.56*100)/5=51.2%
Trộn 5,4g bột Al với 17,4g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng, dư thì thu được 5,376 lít H2 (dktc). Hiệu suất của phản ứng nhiệt nhôm là:
A. 62,5%
B. 60%
C. 20%
D. 80%
Đáp án D
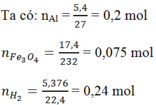

Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒Hỗn hợp rắn sau phản ứng gồm Al dư, Fe3O4 dư, Al2O3 và Fe.
Theo phản ứng: nAl phản ứng = 8/3 x mol ⇒ nAl dư = (0,2 – 8/3 x) mol

![]()
![]()
![]()
Cho 1 lượng bột Al phản ứng vừa đủ với dung dịch có chứa 44,1g H2so4 ,thu được muối Al2(so4)3 Và Khí H2.
A)tính Khối Lượng Al Phản Ứng
B)tính Thể Tích Khí H2( ở Đktc)
C)tính Khối Lượng AL2(So4)3 Theo 2 Cách
a) $n_{H_2SO_4} = \dfrac{44,1}{98} = 0,45(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{Al} = \dfrac{2}{3}n_{H_2SO_4} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
b) $n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$\Rightarrow V_{H_2} = 0,45.22,4 =1 0,08(lít)$
c)
Cách 1 : $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,15(mol)$
$\Rightarrow m_{Al_2(SO_4)_3} = 0,15.342 = 51,3(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{Al_2(SO_4)_3} = 8,1 + 44,1 - 0,45.2 = 51,3(gam)$