Trong tự nhiên đồng có 2 đồng vị là 65Cu và 63Cu với tỉ số 63Cu/65Cu=105/245. Tính nguyên tử khối của Cu

Những câu hỏi liên quan
Đồng trong tự nhiên có 2 đồng vị 6529Cu, 6329Cu với tỷ số 63Cu/ 65Cu = 105/ 245.Tính nguyên tử khối của Cu
Phần trăm đồng vị $^{63}Cu$ là : $\dfrac{105}{105 + 245}.100\% = 30\%$
Phần trăm đồng vị $^{65}Cu$ là : $100\% -30\% = 70\%$
Nguyên tử khối Cu : $M = 63.30\% + 65.70\% = 64,4(đvC)$
Đúng 0
Bình luận (0)
Trong tự nhiên đồng có 2 đồng vị là 65Cu và 63Cu với tỉ số 63Cu/65Cu=105/245. Tính nguyên tử khối của Cu
Gọi % 63Cu là a% => % 65Cu = (100-a ) %
Theo bài ra : \(\frac{a}{100-a}=\frac{105}{245}\) => a = 30%
\(M_{Cu}=\frac{63.30+65.70}{100}=64,4\) ( u)
Đúng 1
Bình luận (0)
nguyên tử khối trung bình của Cu
Mtb(Cu) = 105.63+245.65 =64,4 (g/mol)
105 + 245
Đúng 0
Bình luận (3)
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4? A. 28,83%. B. 10,97% C. 11,00%. D. 28,74%.
Đọc tiếp
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4?
A. 28,83%.
B. 10,97%
C. 11,00%.
D. 28,74%.
Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
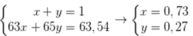
Phần trăm khối lượng của 63Cu trong CuSO4 là
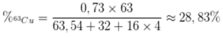
Đúng 0
Bình luận (0)
trong tự nhiên đồng có 2 đồng vị 63cu và 65cu .Nguyên tử khối trung bình của Cu là 63,54. a,Tính phần trăm số nguyên tử mỗi loại đồng vị b.Tính thành phần phần trăm theo khối lượng của 65Cu trong CuSO
a)
Gọi thành phần phần trăm của hai đồng vị 63Cu ,65Cu lần lượt là a,b
Ta có :
a + b = 100%
63a + 65b = 63,54
Suy ra a = 0,73 = 73% ; b = 0,27 = 27%
b) Thành phần phần trăm khối lượng của 65Cu trong CuSO4 là :
\(\dfrac{65.27\%}{63,54 + 32 + 16.4 }.100\% = 11\%\)
Đúng 2
Bình luận (0)
Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về số nguyên tử. Phần trăm khối lượng của 63Cu trong CuCl2
Đồng vị \(^{65}Cu\) chiếm 27% về số nguyên tử.
\(\Rightarrow\)Đồng vị \(^{63}Cu\) chiếm 73% về số nguyên tử.
Số nguyên tử khối:
\(\overline{A_{Cu}}=\dfrac{65\cdot27+63\cdot73}{100}=63,54\)
\(\%m_{^{63}Cu}=\dfrac{63\cdot0,73}{63,54+2\cdot35,5}\cdot100\%=34,18\%\)
Đúng 1
Bình luận (0)
Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về số nguyên tử. Phần trăm khối lượng của 63Cu trong CuCl2
Đồng trong tự nhiên có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình là 63,54.
a/ Xác định phần trăm của mỗi loại đồng vị.
b/ Hỏi mỗi khi có 108 nguyên tử 65Cu thì có bao nhiêu nguyên tử 63Cu?
c/ Tính phần trăm khối lượng của đồng vị 65Cu lần lượt trong Cu2O và CuCl2
Trong tự nhiên Cu có 2 đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54 đvC. Thành phần phần trăm tổng số nguyên tử của 63Cu là A. 73%. B. 27%. C. 54%. D. 50%.
Đọc tiếp
Trong tự nhiên Cu có 2 đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54 đvC. Thành phần phần trăm tổng số nguyên tử của 63Cu là
A. 73%.
B. 27%.
C. 54%.
D. 50%.
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là? A. 73%. B. 64,29%. C. 35,71%. D. 27%.
Đọc tiếp
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là?
A. 73%.
B. 64,29%.
C. 35,71%.
D. 27%.
Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
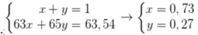
Phần trăm khối lượng của 63Cu trong Cu2O là
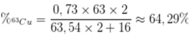
Đúng 1
Bình luận (0)

















