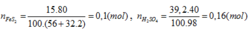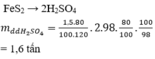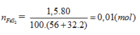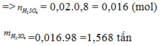Bài 1/Từ 320 tấn quặng pirit sắt FeS2 có chứa 45% lưu huỳnh đã sản xuất được 450 tấn axit sunfuric. Hãy xác định hiệu suất của quá trình sản xuất.
Bài 2/ Từ 1 tấn quặng pirit sắt chứa 80% FeS2 có thể điều chế được bao nhiêu tấn dung dịch HsSO4 60%? Biết rằng sự hao hụt trong sản xuất là 5%