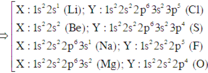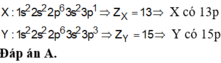1. Nguyên tử X có electron cuối cùng điền vào phân lớp 3d5. ậy nguyên tử X có số lớp electron làA.3 B. 4. C. 5. D. 7. 2.Nguyên tử X có cấu hình electron ở phân lớp 3d chỉ bằng 1 nửa ở phân lớp 4s.Số hiệu nguyên tử của X làA. 20. B. 24. C. 21. D. 263.Nguyên tử X, Y có cấu hình electron lớp ngoài cùng lần lượt là 3sx và 3s23py. Tổng số electron trên các phân lớp electron ngoài cùng của X, Y là 6. Vậy số hiệu nguyên tử của X, Y có thể làA. 11 và 16 B. 11 và 15 ...
Đọc tiếp
1. Nguyên tử X có electron cuối cùng điền vào phân lớp 3d5. ậy nguyên tử X có số lớp electron là
A.3 B. 4. C. 5. D. 7.
2.Nguyên tử X có cấu hình electron ở phân lớp 3d chỉ bằng 1 nửa ở phân lớp 4s.Số hiệu nguyên tử của X là
A. 20. B. 24. C. 21. D. 26
3.Nguyên tử X, Y có cấu hình electron lớp ngoài cùng lần lượt là 3sx và 3s23py. Tổng số electron trên các phân lớp electron ngoài cùng của X, Y là 6. Vậy số hiệu nguyên tử của X, Y có thể là
A. 11 và 16 B. 11 và 15 C. 12 và 16 D. 12 và 14
4. Nguyên tử của nguyên tố X (Z ≤ 25) và có 3 electron ở phân mức năng lượng cao nhất. Biết tỉ lệ số electron s và p của nguyên tử X là 2:3. Số hiệu nguyên tử của nguyên tố trên là
A. 22. B. 15. C. 20. D. 10.
5.Cho các nguyên tử sau: X (Z = 11), Y (Z = 20), R (Z = 24), T (Z = 29). Các nguyên tử có số electron ở lớp ngoài cùng bằng nhau là
A. Y, R, T B. Y, T C. X, R, T D. Y, R
6. Nguyên tố M có 3 lớp electron và có 4 e lớp ngoài cùng. Vậy M là
A. Phi kim B. Khí hiếm
C. Kim loại D. Kim loại hoặc phi kim
7.Cho kí hiệu nguyên tử sắt là 56 Fe . Kết luận nào sau đây là sai
A. Cấu hình e của sắt có thể viết gọn là [Ar] 3d64s2.
B. Sắt là kim loại vì có 2e lớp ngoài cùng.
C. Cấu hình e ở lớp thứ 3 của sắt chưa bão hòa.
D. Sắt là nguyên tố s vì có phân lớp ngoài cùng là phân lớp 4s
Chọn và giải thích(nếu được) giúp e nha mn. E cảm ơn