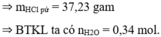Cho 8,3g hỗn hợp Fe, Al tác dụng với 200ml dung dịch H2SO4 2M. Phản ứng kết thúc thu được dung dịch X và thoát ra 5,6l khí ở đktc. Cho dung dịch X tác dụng với 420ml dd NaOH 2M được m(g) kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được m1(g) chất rắn Z. Tìm m,m1

Những câu hỏi liên quan
Cho 8,3g hỗn hợp Fe, Al tác dụng với 200ml dung dịch H2SO4 2M. Phản ứng kết thúc thu được dung dịch X và thoát ra 5,6l khí ở đktc. Cho dung dịch X tác dụng với 420ml dd NaOH 2M được m(g) kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được m1(g) chất rắn Z. Tìm m,m1
Cho 8,3g hỗn hợp Fe, Al tác dụng với 200ml dung dịch H2SO4 2M. Phản ứng kết thúc thu được dung dịch X và thoát ra 5,6l khí ở đktc. Cho dung dịch X tác dụng với 420ml dd Ba(OH)2 1M được m(g) kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được m1(g) chất rắn Z. Tìm m,m1
\(n_{Fe}=x;n_{Al}=y\\ n_{H_2SO_4}=2.0,2=0,4\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(hpt_{\left(1\right)}:\left\{{}\begin{matrix}56x+27y=8,3\\22,4\left(x+1,5y\right)=5,6\end{matrix}\right.\Leftrightarrow x=y=0,1\)
\(n_{H_2SO_4.du}=0,4-\left(x+3y\right)=0,4-0,4=0\left(mol\right)\)
\(\rightarrow H_2SO_4.k.du\)
\(PTHH:FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
\(PTHH:Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow3BaSO_4\downarrow+2Al\left(OH\right)_3\downarrow\)
\(n_{Ba\left(OH\right)_2}=1.0,42=0,42\left(mol\right)\)
\(n_{Ba\left(OH\right)_2.du}=0,42-\left(0,1+\frac{0,1}{2}.3\right)=0,17\left(mol\right)\)
→ Tác dụng tiếp với \(Al\left(OH\right)_3\)
\(PTHH:2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
\(\Rightarrow n_{Al\left(OH\right)_3}=2.n_{Ba\left(OH\right)_2}=2.0,17=0,34\left(mol\right)\)
\(\Rightarrow\sum_{n_{Al\left(OH\right)_3}}=0,34+0,1.2=0,54\left(mol\right)\)
\(PTHH:Fe\left(OH\right)_2\underrightarrow{t^o}FeO+H_2O\)
\(PTHH:2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
\(m_{kt}=0,1.90+0,54.78=51,12\left(g\right)\)
\(m_1=0,1.72+\frac{0,54}{2}.102=34,74\left(g\right)\)
Đúng 0
Bình luận (2)
Cho 8,3g hỗn hợp Fe, Al tác dụng với 200ml dung dịch H2SO4 2M. Phản ứng kết thúc thu được dung dịch X và thoát ra 5,6l khí ở đktc. Cho dung dịch X tác dụng với 420ml dd Ba(OH)2 1M được m(g) kết tủa Y. Nung Y trong không khí đến khối lượng không đổi được m1(g) chất rắn Z. Tìm m,m1
Đặt :
nFe = x mol
nAl = y mol
<=> 56x + 27y = 8.3 g (1)
nH2 = 0.25 mol
nH2SO4 = 0.4 mol
nNaOH = 0.84 mol
Fe + H2SO4 --> FeSO4 + H2
x_______________x______x
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y_________________y_________1.5y
<=> x + 1.5y = 0.25 (2)
Giải (1) và (2) :
x = y = 0.1
dd X : H2SO4 dư 0.15 mol , FeSO4 0.1 mol , Al2(SO4)3 0.1 mol
2NaOH + H2SO4 --> Na2SO4 + H2O
0.3_______0.15
FeSO4 + 2NaOH --> Fe(OH)2 + Na2SO4
0.1_______0.2 _______0.1
=> nNaOH còn lại = 0.84 - 0.3 - 0.1 = 0.44 mol
Al2(SO4)3 + 6NaOH --> 2Al(OH)3 + 3Na2SO4
Bđ: 0.1__________0.44
Pư: 11/150________0.44_______11/75
Kt : 2/75__________0_________11/75
mKt = m = mFe(OH)2 + mAl(OH)3
= 0.1*90 + 11/75*78
= 20.44 g
4Fe(OH)2 + O2 -to-> 2Fe2O3 + 4H2O
0.1__________________0.05
2Al(OH)3 -to-> Al2O3 + 3H2O
11/75___________11/50
mZ = m1 = 0.05*160 + 11/50*102 = 30.44 g
Đúng 0
Bình luận (3)
Cho 8,3g hỗn hợp kim loại Fe và Al tác dụng với dung dịch HCL dư thu được dung dịch X và 5,6 lít H2(đktc) Cho dung dịch X tác dụng với lượng dư NaOH thu được m gam kết tủa.Nung kết tủa trong không khí đến khối lượng không đổi thu được a gam chất rắn.Viết PTPƯ và tính m,a
Các PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
Kết tủa thu được gồm Fe(OH)2 và Al(OH)3
Đặt : \(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(\Rightarrow56a+27b=8,3g\left(1\right)\)
\(Bte:2n_{Fe}+3n_{Al}=2n_{H2}=2a+3b=2.\dfrac{5,6}{22,4}=\left(2\right)\)
Từ(1),(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1=n_{Fe\left(OH\right)2}\\b=0,1=n_{Al\left(OH\right)3}\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)2}+m_{Al\left(OH\right)3}=0,1.90+0,1.78=16,8\left(g\right)\)
\(Bt\left(Al\right):n_{Al}=n_{Al2O3}=0,1\left(mol\right)\)
\(Bt\left(Fe\right):n_{Fe}=n_{Fe2O3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Chất.rắn}=0,1.160+0,1.102=26,2\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Đầu tiên, chúng ta sẽ viết các phương trình phản ứng cho mỗi bước của quá trình.
Bước 1: Phản ứng giữa hỗn hợp Fe và Al với dung dịch HCl: HCl (dung dịch) + Fe (kim loại) → FeCl2 (dung dịch) + H2 (khí)
2HCl + Fe → FeCl2 + H2
Bước 2: Phản ứng giữi dung dịch X với NaOH tạo kết tủa: X (dung dịch) + 2NaOH → 2NaX (dung dịch) + H2O (lỏng) + Al(OH)3 (kết tủa)
Bước 3: Nung kết tủa Al(OH)3 trong không khí: 2Al(OH)3 → Al2O3 + 3H2O
Bây giờ, chúng ta sẽ tính toán m và a.
Bước 1: Tính lượng H2 thoát ra.
Trước hết, chúng ta cần biết lượng mol của Fe trong hỗn hợp. Công thức của FeCl2 là Fe2+ (một cation sẽ tạo ra 1 mol H2 khi phản ứng với HCl). Vì vậy, số mol của Fe là bằng số mol H2.
Khối lượng mol của H2 là 2 g/mol, vì vậy số mol H2:
n(H2) = 5.6 l / 22.4 l/mol (ở điều kiện tiêu chuẩn) = 0.25 mol
Do đó, số mol Fe = 0.25 mol.
Khối lượng mol của Fe là 55.85 g/mol, vậy khối lượng của Fe là:
m(Fe) = 0.25 mol × 55.85 g/mol = 13.96 g
Bước 2: Tính lượng kết tủa Al(OH)3.
Al(OH)3 có khối lượng mol là 78 g/mol, và theo phương trình phản ứng ta thấy rằng mỗi mol Al(OH)3 tạo ra một mol kết tủa. Vì vậy, số mol Al(OH)3 tạo ra là bằng số mol NaOH đã sử dụng.
Số mol NaOH đã sử dụng được tính theo số mol H2O được tạo ra khi NaOH phản ứng. Một mol NaOH phản ứng với một mol H2O.
n(Al(OH)3) = n(NaOH) = n(H2O) = 0.25 mol
Khối lượng của Al(OH)3:
m(Al(OH)3) = 0.25 mol × 78 g/mol = 19.5 g
Bước 3: Nung kết tủa Al2O3 trong không khí.
Khối lượng của Al2O3 không thay đổi sau quá trình nung. Vì vậy, a = 19.5 g (cùng với m(Al(OH)3)).
Tóm lại:
m = 19.5 g (kết tủa Al(OH)3)a = 19.5 g (sau khi nung thành Al2O3)
Đúng 0
Bình luận (0)
cho dd NaOH 2M tác dụng vừa đủ với 200ml dd FeCl3 1,5M. Sau khi phản ứng kết thúc thu được kết tủa X và dung dịch A. Lọc kết tủa X và nung đến khối lượng không đổi thu được chất rắn Y.
a) Viết các phản ứng đã xảy ra
b) Tính thể tích dung dịch natri hidroxit đã dùng và nồng độ mol của dd A. Cho rằng thể tích dd thay đổi ko đáng kể khi phản ứng
c) Tính khối lượng kết tủa X và chấ t rắn Y
Đọc tiếp
cho dd NaOH 2M tác dụng vừa đủ với 200ml dd FeCl3 1,5M. Sau khi phản ứng kết thúc thu được kết tủa X và dung dịch A. Lọc kết tủa X và nung đến khối lượng không đổi thu được chất rắn Y. a) Viết các phản ứng đã xảy ra b) Tính thể tích dung dịch natri hidroxit đã dùng và nồng độ mol của dd A. Cho rằng thể tích dd thay đổi ko đáng kể khi phản ứng c) Tính khối lượng kết tủa X và chấ t rắn Y
\(a,PTHH:3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\downarrow\\ 2Fe\left(OH\right)_3\rightarrow^{t^o}Fe_2O_3+3H_2O\uparrow\\ b,n_{FeCl_3}=1,5\cdot0,2=0,3\left(mol\right)\\ \Rightarrow n_{NaOH}=3n_{FeCl_3}=0,9\left(mol\right)\\ \Rightarrow V_{dd_{NaOH}}=\dfrac{0,9}{2}=0,45\left(l\right)\)
Theo đề: \(\left\{{}\begin{matrix}X:Fe\left(OH\right)_3\\A:NaCl\\Y:Fe_2O_3\end{matrix}\right.\)
Theo PT: \(n_{NaCl}=3n_{FeCl_3}=0,9\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,9}{0,45+0,2}\approx1,4M\)
\(c,\) Theo PT: \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=0,3\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_X=m_{Fe\left(OH\right)_3}=0,3\cdot107=32,1\left(g\right)\\m_Y=m_{Fe_2O_3}=0,15\cdot160=24\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?b/ Tính V?c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
Đọc tiếp
: Cho 11 gam hỗn hợp hai kim loại Al và Fe tác dụng vừa đủ với V ml dd H2SO4 0,2M, sau phản ứng thu được dung dịch X và khí Y. Cho dung dịch X tác dụng vừa đủ với dung dịch NaOH 10%, thì khối lượng kết tủa lớn nhất thu được là 24,6 gam.
a/ Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b/ Tính V?
c/ Tính khối lượng dung dịch NaOH cần dùng ở trên?
d/ Đem kết tủa nung ngoài không khí đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
\(a,\) Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=11(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Al_2(SO_4)_3+6NaOH\to 2Al(OH)_3\downarrow+3Na_2SO_4\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{Al(OH)_3}=x;n_{Fe(OH)_2}=y\\ \Rightarrow 78x+90y=24,6(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,1(mol) \end{cases} \Rightarrow \begin{cases} m_{Al}=0,2.27=5,4(g)\\ m_{Fe}=11-5,4=5,6(g) \end{cases}\)
\(b,\Sigma n_{H_2SO_4}=1,5x+y=0,4(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,4}{0,2}=2(l)\\ c,\Sigma n_{NaOH}=3x+2y=0,8(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,8.40}{10\%}=320(g)\\ d,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ Fe(OH)_2\xrightarrow{t^o}FeO+H_2O\\ \Rightarrow n_{Al_2O_3}=0,1(mol);n_{FeO}=0,1(mol)\\ \Rightarrow m_{\text{chất rắn}}=0,1.102+0,1.72=17,4(g)\)
Đúng 1
Bình luận (0)
Hòa tan hết m gam hỗn hợp Fe, Mg vào 100 ml dung dịch H2SO4 loãng, thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư KNO3, thu được dung dịch Y và 168 ml khí NO (đktc). Nhỏ dung dịch HNO3 loãng, dư vào dung dịch Y thì thấy thoát ra thêm 56 ml khí NO (đktc) nữa. Cũng lượng dung dịch X ở trên, cho phản ứng với dung dịch NaOH dư, thu được 5,6 gam kết tủa. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị m là A. 3,52 B. 2,96 C. 2,42 D. 2,88
Đọc tiếp
Hòa tan hết m gam hỗn hợp Fe, Mg vào 100 ml dung dịch H2SO4 loãng, thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư KNO3, thu được dung dịch Y và 168 ml khí NO (đktc). Nhỏ dung dịch HNO3 loãng, dư vào dung dịch Y thì thấy thoát ra thêm 56 ml khí NO (đktc) nữa. Cũng lượng dung dịch X ở trên, cho phản ứng với dung dịch NaOH dư, thu được 5,6 gam kết tủa. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị m là
A. 3,52
B. 2,96
C. 2,42
D. 2,88
Hòa tan hỗn hợp gôm Al, Fe và Cu bằng dd H2SO4 loăng thu được dung dịch X,Cho dung dịch X tác dụng với dung dịch NaOH dư thu được kết tủa Y. Nung kết tủa Y trong không khí đến khối lượng không đổi thu được chất rắn A. CuO, Fe2O3 B. CuO, Al2O3, FeO C. Al2O3, FeO D. Fe2O3
Đọc tiếp
Hòa tan hỗn hợp gôm Al, Fe và Cu bằng dd H2SO4 loăng thu được dung dịch X,Cho dung dịch X tác dụng với dung dịch NaOH dư thu được kết tủa Y. Nung kết tủa Y trong không khí đến khối lượng không đổi thu được chất rắn
A. CuO, Fe2O3
B. CuO, Al2O3, FeO
C. Al2O3, FeO
D. Fe2O3
Hòa tan bằng H2SO4 => Cu không tác dụng
Cho tác dụng NaOH dư chỉ còn lại kết tủa của Fe
Nung hidoxit của Fe trong không khí => thu được Fe2O3 => Đap an D
Đúng 0
Bình luận (0)
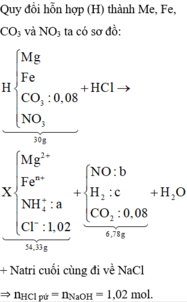
Cho 30 gam hỗn hợp (H) gồm Mg, FeCO3, Fe và Fe(NO3)2 tác dụng vừa đủ với dung dịch HCl, kết thúc phản ứng thu được dung dịch X chứa 54,33 gam muối và 6,78 gam hỗn hợp khí Y gồm NO; H2 và 0,08 mol CO2. Cho dung dịch X tác dụng tối đa với 510 ml dung dịch NaOH 2M, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 26,4 gam rắn. Phần trăm khối lượng của kim loại Fe trong (H) có giá trị gần nhất với A. 46%. B. 20%. C. 19%. D. 45%.
Đọc tiếp
Cho 30 gam hỗn hợp (H) gồm Mg, FeCO3, Fe và Fe(NO3)2 tác dụng vừa đủ với dung dịch HCl, kết thúc phản ứng thu được dung dịch X chứa 54,33 gam muối và 6,78 gam hỗn hợp khí Y gồm NO; H2 và 0,08 mol CO2. Cho dung dịch X tác dụng tối đa với 510 ml dung dịch NaOH 2M, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 26,4 gam rắn. Phần trăm khối lượng của kim loại Fe trong (H) có giá trị gần nhất với
A. 46%.
B. 20%.
C. 19%.
D. 45%.