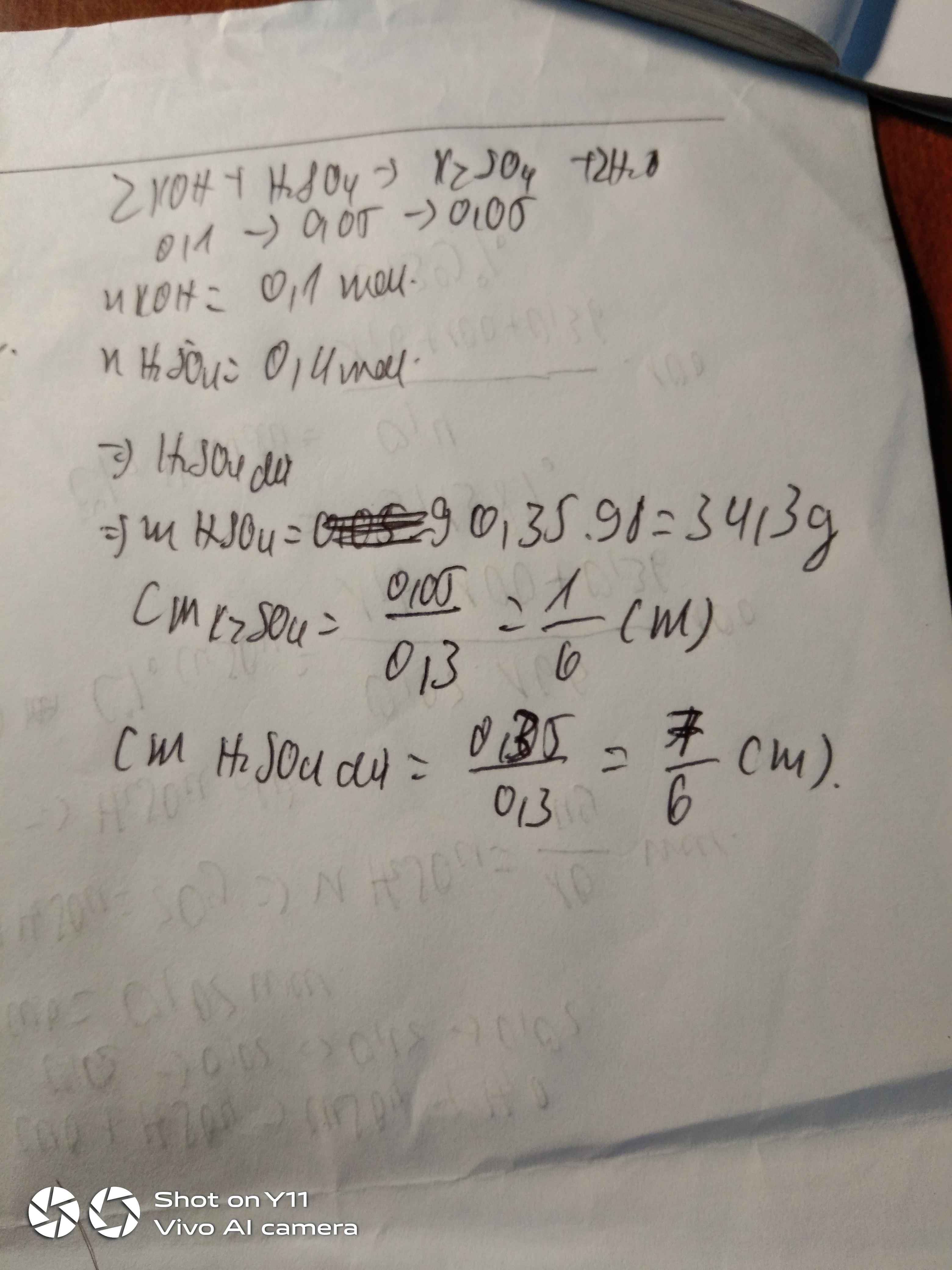Cho 39,9g K2SO3.6H2O vào dd H2SO4 14%. Tính nồng độ % các chất sau phản ứng

Những câu hỏi liên quan
hòa tan 40g Mgo vào 300g dd H2SO4 98%. Tính nồng độ phần trăm các chất trong dd sau phản ứng
PTHH: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{40}{40}=1\left(mol\right)\\n_{H_2SO_4}=\dfrac{300\cdot98\%}{98}=3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{MgSO_4}=1\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{120}{300+40}\cdot100\%\approx35,3\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{2\cdot98}{300+40}\cdot100\%\approx57,65\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
cho 5,4g sắt vào 100ml dd h2SO4
a tính thể tích khí h2 sinh ra ở đktc
b tính nồng độ mol các chất trong dd sau phản ứng
Sửa đề cho dễ làm: "Cho 5,6 gam sắt"
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Gộp cả phần a và b
Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)=n_{FeSO_4}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,1}=1\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
-Mình sửa đề là 5,6 g sắt nhé :)
Đổi 100ml = 1lit
PTHH: Fe +H2SO4→FeSO4+H2
+nFe=\(\dfrac{5,6}{56}=0,1\left(mol\right)\)
-Theo PTHH ta có:
+nH2=nFe=0,1(mol)
+VH2=0,1.22,4=2,24(lit)
-Theo PTHH ta có:
+nH2SO4=nFe=0,1(mol)
+CMH2SO4=\(\dfrac{0,1}{0,1}=1\) (M)
Đúng 0
Bình luận (0)
Cho m gam dd H2SO4 7% vào 104g dd Bacl2 10% ( tác dụng vừa đủ). Tính m và nồng độ % các chất trong dd thu được sau phản ứng?
nBaCl2=\(\frac{104.10\%}{208}=0,05mol\)
H2SO4 + BaCl2=> BaSO4 + 2HCl
0,05<------0,05----->0,05------>0,1
mdd H2SO4 =\(\frac{0,05.98.100}{7}=70\left(g\right)\)
m tủa = 0,05.233=11,65(g)
mdd = 70+104-11,65=162,35 (g)
C% HCl = \(\frac{0,1.36,5}{162,35}.100\%=2,248\%\)
Đúng 0
Bình luận (0)
Cho 5.4 gam Al vào 294 gam dd H2SO4 20% . Tính nồng độ phần trăm chất tan có trong dd sau phản ứng?
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Ta lại có: \(C_{\%_{H_2SO_4}}=\dfrac{m_{H_2SO_4}}{294}.100\%=20\%\)
=> \(m_{H_2SO_4}=58,8\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
Ta thấy: \(\dfrac{0,2}{1}=\dfrac{0,6}{3}\)
Vậy không có chất dư.
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2\left(g\right)\)
Ta có: \(m_{dd_{Al_2\left(SO_4\right)_3}}=294+5,4-\left(\dfrac{3}{2}.0,2.2\right)=298,8\left(g\right)\)
=> \(C_{\%_{Al_2\left(SO_4\right)_3}}=\dfrac{34,2}{298,8}.100\%=11,45\%\)
Đúng 0
Bình luận (0)
Cho 1,6g CuO tác dụng hết với dd sulfuric H2SO4 có nồng độ 20%.
a, Viết PTHH.
b) Tính khối lượng dung dịch H2SO4 đã phản ứng
c) Tính nồng độ % của các chất có trong dd sau khi phản ứng kết thúc.
CuO+H2SO4->CuSO4+H2O
0,02----------------0,02 mol
n CuO=1,6\80=0,02 mol
=>m CuSO4=0,02.160=3,2g
=>thiếu dữ kiện
Đúng 0
Bình luận (1)
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
Cho 360 gam dd Na2CO3 21,2% (D=1,2g/ml) vào 200 ml dd H2SO4 2,5M (d=1,1) sau phản ứng thu được dd A và khí CO2.
a. Tính thể tích khí CO2 ở đkc.
b. Tính nồng độ % và nồng độ mol/l của các chất trong dd A.
\(n_{Na_2CO_3}=\dfrac{360.21,2\%}{100\%.106}=0,72(mol)\\ n_{H_2SO_4}=2,5.0,2=0,5(mol)\\ PTHH:Na_2CO_3+H_2SO_4\to Na_2SO_4+H_2O+CO_2\uparrow\\ a,\text {Vì }\dfrac{n_{Na_2CO_3}}{1}>\dfrac{n_{H_2SO_4}}{1} \text {nên }Na_2CO_3\text { dư}\\ \Rightarrow n_{CO_2}=n_{H_2SO_4}=0,5(mol)\\ \Rightarrow V_{CO_2}=0,5.22,4=11,2(l)\\\)
\(b,A:Na_2SO_4\\ n_{Na_2SO_4}=n_{H_2SO_4}=0,5(mol)\\ m_{dd_{H_2SO_4}}=200.1,1=220(g);V_{dd_{Na_2CO_3}}=\dfrac{360}{1,2}=300(ml)=0,3(l)\\ \Rightarrow C\%_{Na_2SO_4}=\dfrac{0,5.142}{360+200-0,5.44}.100\%=13,2\%\\ C_{M_{Na_2SO_4}}=\dfrac{0,5}{0,3+0,2}=1M\)
Đúng 0
Bình luận (0)
Cho 114g dd h2so4 20% vào 400g dd bacl2 5,2%. a) lập phương trình hoá học b) tính khối lượng kết tủa thu đc c) tính nồng độ phần trăm của các chất trong dd sau phản ứng
a, \(H_2SO_4+BaCl_2\rightarrow BaSO_{4\downarrow}+2HCl\)
b, Ta có: \(m_{H_2SO_4}=114.20\%=22,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{22,8}{96}=0,2375\left(mol\right)\)
\(m_{BaCl_2}=400.5,2\%=20,8\left(g\right)\Rightarrow n_{BaCl_2}=\dfrac{20,8}{208}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2375}{1}>\dfrac{0,1}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{BaSO_4}=n_{BaCl_2}=0,1\left(mol\right)\Rightarrow m_{BaSO_4}=0,1.233=23,3\left(g\right)\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4\left(pư\right)}=n_{BaCl_2}=0,1\left(mol\right)\\n_{HCl}=2n_{BaCl_2}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2375-0,1=0,1375\left(mol\right)\)
Ta có: m dd sau pư = 114 + 400 - 23,3 = 490,7 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,1375.98}{490,7}.100\%\approx2,75\%\\C\%_{HCl}=\dfrac{0,2.36,5}{490,7}.100\%\approx1,49\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
1.Hòa tan 100g dd K2SO3 nồng độ 21,6% vào 200ml dd H2SO4(D=1,04g/ml)
a)Tính khối lượng chất dư sau phản ứng
b)Tính nồng độ % các chất tan sau phản ứng
2.Hóa tan hoàn toàn 11g hỗn hợp gồm Fe và Al bằng 1 lượng dd H2SO4 2M(vừa đủ) người ta thu được 8,96 lít khi ở đktc