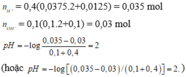1.Trộn 100ml dd HCl 0,1M và HNO3 0,1M vào 100ml dd NaOH 0,1M và Ca(OH)2 0,1M. Tính pH dd?

Những câu hỏi liên quan
1) Tron 200ml dd HCl 0,1M voi 100ml dd HNO3 0,1M thu duoc dd A. Tinh the tich dd Ba(OH)2 0,02M can dung de trung hoa vua dung 100ml dd A
Đặt V (l) là thể tích dung dịch bazo cần tìm.
Ta có:
Mà
+)
(vì có 2 nhóm trong dd ).
Ta có phương trình ion thu gọn sau:
Theo PTHH:
Đúng 0
Bình luận (0)
100 ml dd A có \(n_{H^+}=\dfrac{0,1.0,2+0,1.0,1}{3}=0,01\left(mol\right)\).
Để trung hòa thì cần \(n_{OH^-}=n_{H^+}=0,01\left(mol\right)\).
\(\Leftrightarrow0,02.2.V_{Ba\left(OH\right)_2}=0,01\)
\(\Leftrightarrow V_{Ba\left(OH\right)_2}=0,25\)
Đúng 0
Bình luận (0)
1 Để trung hòa \(\Leftrightarrow\)nOH-=nH+
nH+=VA*\(C_M\)=0,1*(0,1+0,1)=0,02mol
\(\Rightarrow\)n\(OH^-\)=0,02 mol
V=\(\dfrac{2n_{OH^-}}{C_M}\)(do n\(OH^-\)=2n\(Ba\left(OH\right)_2\))
=\(\dfrac{2\cdot0,02}{0,02}\)=2l
Đúng 0
Bình luận (0)
Trộn 100ml dd gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd gồm H2SO4 0,0375M và HCl 0,0125M thu đc dd X. Tính pH dd X
Cho 100ml dd chứa Ba(OH)2 0,1M và KOH 0,2M vào 100ml dd chứa hcl 0,2M và HNO3 0,2M được dd Z. a) Tính pH của dung dịch Z b) tính nồng độ mol của 400ml dd nạo dùng để trung hòa hết dd Z
Trộn 100ml dd gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dd gồm : H2SO4 0,0375M và HCl 0,0125M , thu được dung dịch X . Tính pH của dd X .
HELP ME !!!!
100ml dd HCL 0,1M với dd NaOH 0.05M tính pH dd thu được
nHCl=0,1*0,1=0,01mol=nH\(^+\)=0,01 mol
nNaOH=0,1*0,05=5*10\(^{-3}\)=nOH\(^-\)=5*10\(^{-3}\)
H\(^+\) + OH\(^-\) --> H2O
trước 0,01 5*10\(^{-3}\)
p/ứ 5*10\(^{-3}\) 5*10\(^{-3}\)
sau 5*10\(^{-3}\) 0
=>-log(5*10\(^{-3}\))=2,3=>pH=2,3
Đúng 1
Bình luận (0)
Trộn 100 ml dd (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dd (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dd X. Giá trị pH của dd X là
A.7.
B. 2.
C. 1.
D. 6.
Trộn 200ml dd HCl 0,1M với 100ml dd HNO3 0,1M thu được dd A . Tính thể tích dd Ba(OH)2 0,02M cần dùng để trung hòa vừa đúng 100ml dung dịch A .
*dd A : n( H+) / HCI +n ( H+)/ HNO3
= ( 0,1* 0,2 ) + ( 0,1 *0,1 )= 0,02 +0,01 = 0,03 mol
______ n ( CI-) = 0,1*0,2 = 0,02 mol
______n ( NO3) = 0,1*0,1 = 0,01 mol
* BA (OH) 2 vào trung hòa thực chất là phản ứng tạo nước
( OH- )+ (H+)----------> H2O
0,03<------ 0,03
Vậy lượng ( OH-) cần để trung hào 300ml dd A là 0,03 mol ( HCI 200ml + HNO3 100ml =300ml )
=> Để trung hòa 100ml dd A cần n (OH-) = 1/3 số mol cần trung hào 300ml = 0,03 /3 = 0,01mol
=> nBa ( OH )2 = 1/2 n ( OH- )= 0,01/2 = 0,005 mol
=> VBa (OH) 2 = n / Cm = 0,005 / 0,02 = 0,25 lít = 250ml
Đúng 0
Bình luận (0)
A là dd HCl, B là dd Ba(OH)2
- Trộn 50ml dd A với 50ml dd B được dd C làm đỏ quỳ tím. Thêm từ từ dd NaOH 0,1M vào dd C cho tới khi quỳ tím trở lại màu tím thấy hết 50ml dd NaOH.
- Trộn 50ml dd A với 150ml ddB được dd D làm xanh quỳ tím. Thêm từ từ dd HNO3 0,1M vào D cho tới khi quỳ trở lại màu tím thấy hết 350ml dd HNO3. Tính CM của A và B
Trộn 300 ml dd hh gồm H2SO4 0,1M và HCl 0, 15M với V ml dd hh gồm NaOH 0,3M và Ba(OH)2 0,1M, thu được dd X có pH = 12. Giá trị của V là:
\(n_{H^+}=0.3\cdot0.1\cdot2+0.3\cdot0.15=0.105\left(mol\right)\)
\(n_{OH^-}=0.001V\cdot0.3+0.001V\cdot2\cdot0.1=0.0032V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.105.......0.105\)
\(n_{OH^-\left(dư\right)}=0.0032V-0.105\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.0032V-0.105}{0.3+0.001V}\left(M\right)\)
\(pH=14+log\left[OH^-\right]=12\)
\(\Leftrightarrow log\left[OH^-\right]=-2\)
\(\Leftrightarrow log\left[\dfrac{0.0032V-0.105}{0.3+0.001V}\right]=-2\)
\(\Leftrightarrow V=33.85\left(ml\right)\)
Đúng 0
Bình luận (0)
nH+=0,3.0,1.2+0,3.0,15=0,105 mol
nOH- ban đầu =0,3V + 0,1.2V=0,5V mol
Sau phản ứng thu được dung dịch có pH=12
⇒OH- dư ⇒ pOH=2
⇒ [OH- ] dư = 0,01 M
nOH- dư = 0,01(0,3+V)=0,003+0,01V (mol)
nOH- phản ứng=nOH- ban đầu - nOH- dư
= 0,5V - 0,003 - 0,01V
= 0,49V - 0,003 (mol )
H+ + OH- → H2O
0,105 → 0,105
nOH- phản ứng = nH+
⇒0,49V - 0,003 =0,105
⇒ V≃0,22 lít=200ml
Đúng 0
Bình luận (0)