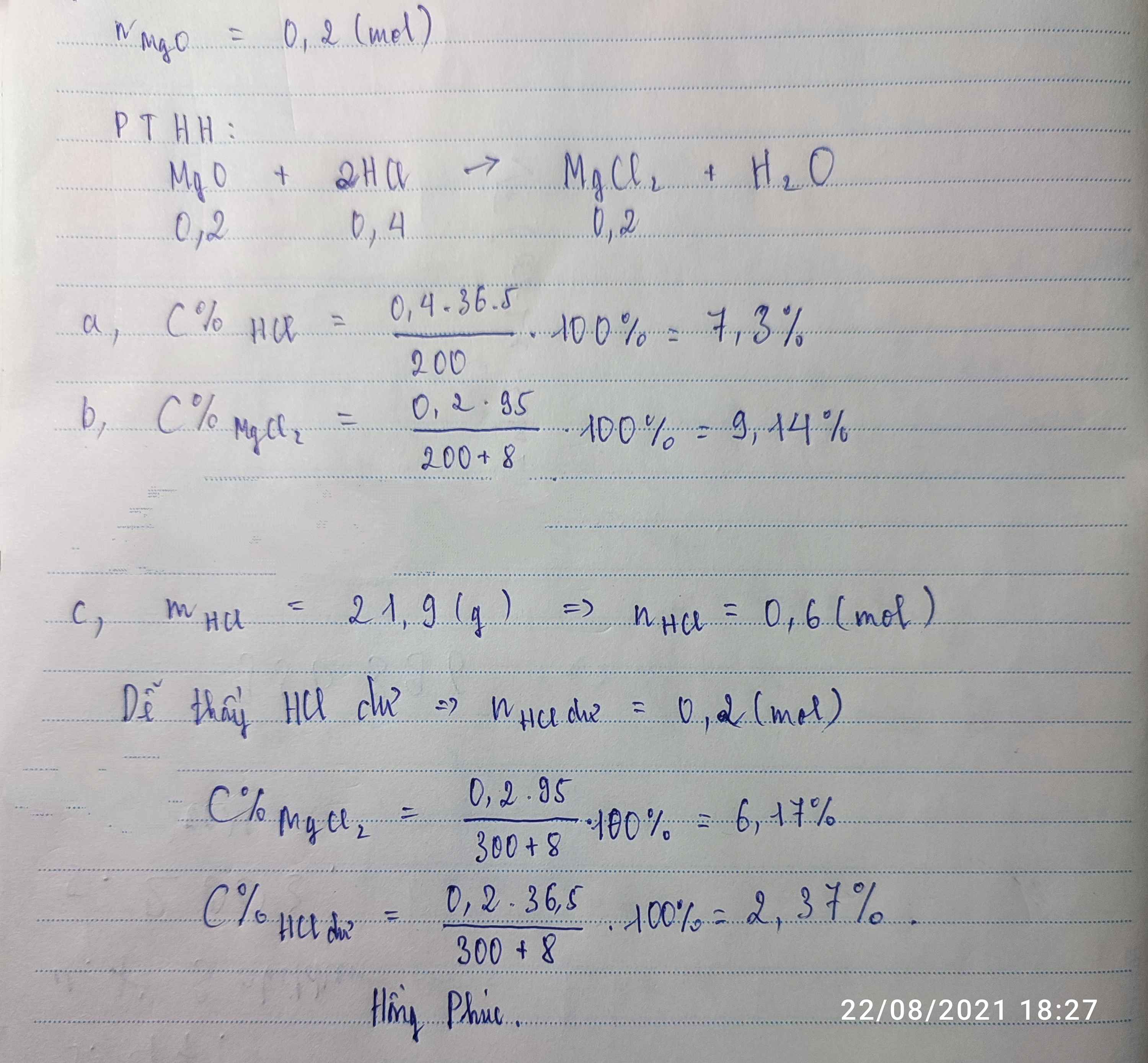Cho m g SO3 hòa tan hoàn toàn trong 200 g dung dịch H2SO4 4,9 % thu đc dd A 9,8%
a) m = ?
b) Cho 5,4g 1 kim loại X có hóa trị k đổi hòa tan vừa đủ trong 300g dd A tạo ra dung dịch B
xác định X
c) Cho dd NaOH 10% vào dd B thấy có 7,8g chất rắn tạo thành và dd C . tính m NaOH cần dùng ???
C% dd C = ???