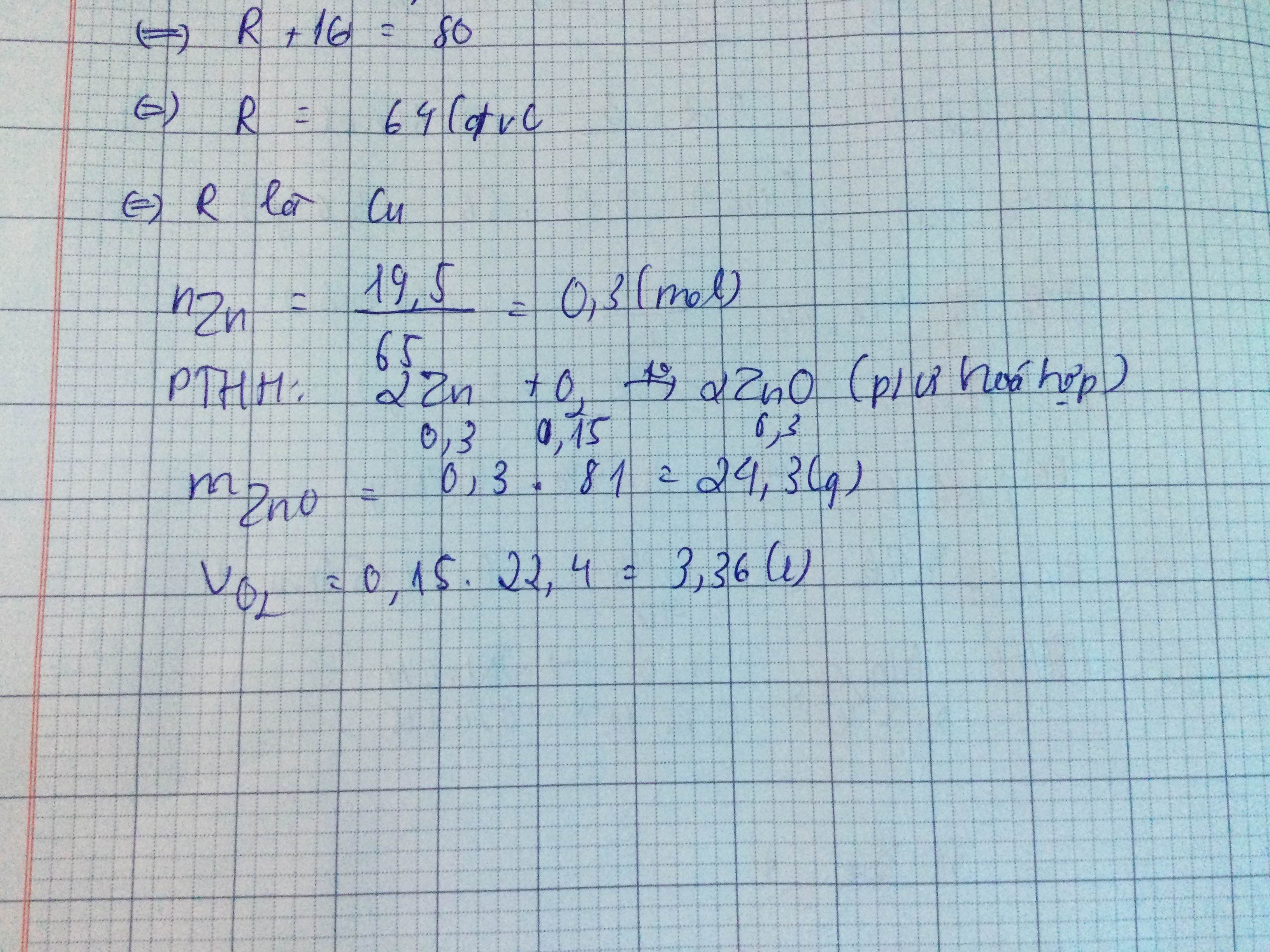Khi đốt photpho cháy trong không khí và trong oxi, ngọn lủa khác nhau nhu thế nào?

Những câu hỏi liên quan
Đốt cháy 1,55g photpho trong bình kín chứa 1,12 lít khí oxi (đktc). a.Viết phương trình hóa học của phản ứng b.Sau phản ứng chất nào còn dư? Khối lượng (nếu P dư) hay thể tích (nếu O2 dư) là bao nhiêu?
a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{1,55}{31}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,05}{4}>\dfrac{0,05}{5}\), ta được P dư.
c, Theo PT: \(n_{P\left(pư\right)}=\dfrac{4}{5}n_{O_2}=0,04\left(mol\right)\Rightarrow n_{P\left(dư\right)}=0,05-0,04=0,01\left(mol\right)\)
\(\Rightarrow m_{P\left(dư\right)}=0,01.31=0,31\left(g\right)\)
Đúng 2
Bình luận (1)
Đốt cháy 3360 ml khí nitơ trong bình chứa thu được 4.48 lít khí oxi ở đktc
a.Viết PTHH xảy ra
b.Chất nào còn dư?Dư bao nhiêu gam
c.Tính khối lượng của các chất
\(n_{N_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(N_2+O_2\underrightarrow{t^o}2NO\)
0,15 0,2 0
0,15 0,15 0,3
0 0,05 0,3
Sau phản ứng oxi còn dư và dư \(m=0,05\cdot32=1,6g\)
\(m_{NO}=0,3\cdot30=9g\)
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 62g Natri ( Na) trong không khí thu được 124g Natri oxit. Khối lượng khí oxi cần dùng là
\(n_{Na_2O}=\dfrac{124}{62}=2\left(mol\right)\)
PTHH: 4Na + O2 --to--> 2Na2O
1<----------2
=> mO2 = 1.32 = 32 (g)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn Photpho trong không khí thì thu được 28,4 gam P2O5 a.tính khối lượng Photpho tham gia phản ứng b. tính thể tích không khí cần dùng để đốt cháy lượng photpho trên(đktc). Biết rằng V kk = 5.V O2
nP2O5= 28,4/ 142=0,2(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
a) nP=4/2 . nP2O5= 2. 0,2=0,4(mol)
=>mP=31.0,4=12,4(g)
b) nO2=5/2. 0,2=0,5(mol)
=>V(O2,đktc)=0,5.22,4=11,2(l)
Vì: Vkk=5.V(O2)
=>Vkk=5.11,2=56(l)
Đúng 4
Bình luận (0)
\(4P+5O_2\buildrel{{t^o}}\over\longrightarrow 2P_2O_5\\ n_{P_2O_5}=\frac{28,4}{142}=0,2(mol)\\ n_P=2n_{P_2O_5}=0,2.2=0,4(mol)\\ a/ m_P=0,4.31=12,4(g)\\ b/\\ n_{O_2}=2,5.n_{P_2O_5}=2,5.0,2=0,5(mol)\\ V_{O_2}=0,5.22,4=11,2(l)\\ V_{kk}=5.V_{O_2}=11,2.5=56(l) \)
Đúng 1
Bình luận (0)
/ Đốt cháy hoàn toàn 19,5g Zn trong khí oxi thu được ZnO.
a/ Viết PTHH. Phản ứng trên thuộc loại phản ứng nào?
b/ Tính khối lượng ZnO tạo thành
c/ Tính thể tích O2 PƯ
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
Đúng 2
Bình luận (4)
a. \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH : 2Zn + O2 -> 2ZnO ( Phản ứng hóa hợp )
0,3 0,15 0,3
b. \(m_{ZnO}=0,3.81=24,3\left(g\right)\)
c. \(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (1)
Câu 1: Đốt cháy hoàn toàn 6,5 gam Kẽm trong bình oxi dư
a. Tính thể tích oxi đã dùng(đktc)
b. Tính khối lượng sản phẩm tạo thành ?
c. nếu trong bình trên có chứa 0,8 gam khí oxi thì chất nào còn dư sau phản ứng? Tìm khối lượng sản phẩm tạo thành
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=0,1 mol
nO2=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
Đúng 1
Bình luận (0)
2Zn+O2-to>2ZnO
0,1---0,05----0,1
n Zn=6,5/65=0,1 mol
n O2=0,8/32=0,025 mol
=>VO2=0,05.22,4=1,12l
=>mZnO=0,1.81=8,1g
c)Zn dư
=>m ZnO=0,05.81=4,05g
Hỗn hợp T gồm các chất mạch hở: anđehit X, axit cacboxylic Y và ancol Z (50 MX MY; X và Z có số mol bằng nhau). Đốt cháy hoàn toàn m gam T, thu được 6,72 lít khí CO2 (đktc). Nếu cho m gam T khi tác dụng với lượng dư Na thu được 0,6 gam khí H2. Mặt khác, m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 43,2 gam Ag. Giá trị của m là A. 28,5. B. 28,7. C. 28,9 D. 29,1
Đọc tiếp
Hỗn hợp T gồm các chất mạch hở: anđehit X, axit cacboxylic Y và ancol Z (50 < MX < MY; X và Z có số mol bằng nhau). Đốt cháy hoàn toàn m gam T, thu được 6,72 lít khí CO2 (đktc). Nếu cho m gam T khi tác dụng với lượng dư Na thu được 0,6 gam khí H2. Mặt khác, m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 43,2 gam Ag. Giá trị của m là
A. 28,5.
B. 28,7.
C. 28,9
D. 29,1
1. hãy cho biết 4,5 .10^23 phân tử oxia, có V ? Lít ở đktcb, có m? g2, Tính V của khí oxi ở đktc cần thiết đốt 1kg than biết 96% C vad 4% S. Tính khối lượng Cacbon đioxit sinh ra3,Đốt cháy hoàn toàn 0,5 kg than chứa 90% C và 10% tạp chất không cháy. Tính V không khí cần dừng bít rằng V không khí 5 lần V của khí oxilàm ơn giúp mình với, mình đang cần gấp cảm ơn trước
Đọc tiếp
1. hãy cho biết 4,5 .10^23 phân tử oxi
a, có V= ? Lít ở đktc
b, có m=? g
2, Tính V của khí oxi ở đktc cần thiết đốt 1kg than biết 96% C vad 4% S. Tính khối lượng Cacbon đioxit sinh ra
3,Đốt cháy hoàn toàn 0,5 kg than chứa 90% C và 10% tạp chất không cháy. Tính V không khí cần dừng bít rằng V không khí =5 lần V của khí oxi
làm ơn giúp mình với, mình đang cần gấp cảm ơn trước
1.a) n O2=\(\frac{4,5.10^{23}}{6.10^{23}}\)=0,75 (mol)
---> V O2 =0,75 . 22,4=16,8(l)
b)m O2= 0,75 . 32=24(g)
2.
m C= 1. 96%=0,96(g) --->n C=\(\frac{0,96}{12}\)=0,08(mol)
m S= 1 . 4%=0,04(g) ---> n S=\(\frac{0,04}{32}\)=0,00125(mol)
PTHH
C + O2 --t*--> CO2
0,08---> 0,08 ---->0,08 (mol)
S + O2 ---t*---> SO2
0,00125 --------> 0,00125
Tổng n O2= 0,08 + 0,00125= 0,08125 (mol)
V O2= 0,08125 . 22,4=1,82 (l)
m CO2= 0,08 . 44=3,52(g)
Đúng 0
Bình luận (0)
3) m C= 0,5 . 90%= 0,45 (g) ==> n C =\(\frac{0,45}{12}\)=0,0375(mol)
C + O2 ----> CO2
0,0375 ----> 0,0375 (mol)
V O2 = 0,0375 . 22,4=0,84 (l)
==>V kk= 5 . 0,84=4,2 (l)
Đúng 0
Bình luận (0)
Để đơn giản ta xem xăng là hỗn hợp các đồng phân của hexan và không khí gồm 80% N2 và 20% O2 (theo thể tích). Tỉ lệ thể tích xăng (hơi) và không khí cần lấy là bao nhiêu để xăng được cháy hoàn toàn trong các động cơ đốt trong ? A. 1 : 9,5 B. 1 : 47,5 C. 1 : 48 D. 1 : 50
Đọc tiếp
Để đơn giản ta xem xăng là hỗn hợp các đồng phân của hexan và không khí gồm 80% N2 và 20% O2 (theo thể tích). Tỉ lệ thể tích xăng (hơi) và không khí cần lấy là bao nhiêu để xăng được cháy hoàn toàn trong các động cơ đốt trong ?
A. 1 : 9,5
B. 1 : 47,5
C. 1 : 48
D. 1 : 50