tiến hành thí nghiệm, cho 8,4g sắt tác dụng với 18,25g axit clohidric
a. sau phản ứng chất nào còn dư và dư bao nhiêu gam ?
b.tính thể tích khí hidro thu được sau phản ứng ở đktc
c. người ta cho 11,7g một mẫu kim loại (hóa trị 1 ) vào nước, thấy có thể tích khí H2 thoát ra đúng bằng thể tích khí H2 thu được ở thí nghiệm trên. xác định tên kim loại ?















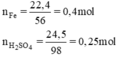

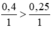 ⇒ Fe dư
⇒ Fe dư









