Cho 78,3 gam mangan đioxit tác dụng với HCl đặc. Lượng Clo thu được dẫn qua 500ml dd NaOH 4M (ở đk thường) được dd A.
a) Viết pt phản ứng
b) Tính nồng độ mol các chất trong dd A (coi Vdd không thay đổi).
Cho 69,6 gam MnO2 tác dụng với dd HCl đặc, dư. Dẫn khí thoát ra đi vào 500ml dd KOH 4M (ở nhiệt độ thường). Xác định nồng độ mol các chất trong dung dịch sau phản ứng (thể tích dd thay đổi không đáng kể).
\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)
1) Cho 500ml dd HCl 1,4M phản ứng với 16g CuO thu được dd A. Xác định khối lượng và nồng độ mol/lít mỗi chất trong dd A.
2) Cho 500ml dd NaOH 1,8M phản ứng với 500ml dd FeCl3 0,8M thu được dd A và chất rắn B. Xác định khối lượng chất rắn B và nồng độ mol/lít mỗi chất trong dd A.
3) Cho 1,96 gam bột Fe vào 100ml dd CuCl2 10% (d=1,12g/ml)
a) Viết phương trình phản ứng.
b) Tính nồng độ mol/lít của chất trong dd sau phản ứng (coi thể tích dd thay đổi không đáng kể)
3)
a) Phương trình phản ứng:
Fe + CuSO4----> FeSO4 + Cu
b)
nFe = 1.96/ 56 = 0.035 (mol)
Khối lượng dung dịch CuSO4 là: m = V. D = 100 x 1.12 = 112 (g)
=> m CuSO4 = 112 x 10% = 11.2 (g)
=> n CuSO4 = 11.2/ 160 = 0.07 (mol)
Fe tác dụng với CuSO4 theo tỉ lệ 1:1 mà nFe < nCuSO4 => Fe hết, CuSO4 dư, như vậy tính toán theo số mol của Fe
Fe + CuSO4----> FeSO4 + Cu
0.035..0.035........0.035.....0.035
=> Nồng độ mol của FeSO4 được tạo thành sau phản ứng trong dung dịch là: 0.035 / 0.1 = 0.35M
Nồng độ mol của CuSO4 dư sau phản ứng là: (0.07 - 0.035)/ 0.1 = 0.35M
2)
3NaOH + FeCl3 --------> Fe(OH)3 + 3NaCl
nNaOH = 0.5*1.8 = 0.9
nFeCl3 bđ = 0.5*0.8 = 0.4
=> nFeCl3 pư = 0.3
=> nFeCl3 dư = 0.1
Chất rắn B là Fe(OH)3
=> mFe(OH)3 = 0.3*107 = 32.1g
Dung dịch A gồm NaCl và FeCl3 dư
Vdd mới = 500 + 500 = 1000ml = 1L
CM NaCl = 0.9M
CM FeCl3 dư = 0.1M
1)
CuO + 2HCl ------> CuCl2 + H2O
nHCl bđ = 0.5*1.4 = 0.7
nCuO = 16/80 = 0.2
=> nHCl pư = 0.4
=> nHCl dư = 0.3
Dung dịch A gồm CuCl2 và HCl dư
mCuCl2 = 0.2*135 = 27g
mHCl dư = 0.3*36.5 = 10.95g
CM CuCl2 = 0.2/0.5 = 0.4M
CM HCl dư = 0.3/0.5 = 0.6M
Cho 9,6 gam Mg tác dụng hết cơi 200ml dd Hcl vừa đủ.Dung dịch sau phản ứng cho tác dụng với dd NaOH dư thu được kết tủa, lọc kết tủa này nung nóng đến khối lượng không đổi đc chất rắn A. a. Viết pthh b. Tính nồng độ mol của dd Hcl đã dùng? c. Tính khối lượng chất rắn A thu đc?
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_{2\downarrow}\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b, Ta có: \(n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,8}{0,2}=4\left(M\right)\)
c, Theo PT: \(n_{MgO}=n_{Mg}=0,4\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,4.40=16\left(g\right)\)
cho 1 lượng kim loại Mg tác dụng hoàn toàn với 500ml dd H2SO4 nồng độ 2M
a) viết PTHH của phản ứng . tính thể tích khí thu được sau phản ứng ở đktc
b) tính nồng độ mol của dd muối tạo thành , coi thể tích dd thay đổi không đáng kể
Bài : Clo
1. Hãy viết 2 phản ứng hóa học khác loại để chứng tỏ rằng clo là một chất oxi hóa rất mạnh. Vì sao clo có tính chất đó ?
2. Nêu các phản ứng chứng minh rằng tính oxi hóa của clo mạnh hơn brom và iot.
3. Mangan đioxit (MnO2) được dùng khi điều chế khí oxi từ kali clorat (KClO3) và được dùng khi điều chế clo từ dd axit clohiđric (HCl). Hãy cho biết vai trò của MnO2 trong mỗi quá trình đó.
4. Khi hòa tan clo vào nước ta thu được nước clo màu vàng nhạt. Khi đó một phần clo tác dụng với nước. Vậy nước clo có chứa những chất gì
5. Thổi khí clo đi qua dung dịch natri cacbonat, người ta thấy có khí cacbonic thoát ra. Hãy giải thích hiện tượng bằng các ph.trình phản ứng.
6. Dùng phương pháp hóa học để nhận biết các chất sau:
Cl2 , CO2 , O2 , H2 .
7. Cho 73 g dd HCl 20 % tác dụng vừa đủ với 500 ml dd KMnO4. Lấy lượng khí X sinh ra tác dụng với lượng dư kim loại M thu được 11,875g muối clorua.
Tính nồng độ mol / lit của dd KMnO4
Xác định kim loại M.
8. Cho 69,6 g mangan đioxit tác dụng hết với dung dịch axit clohiđric đặc. Toàn bộ lượng clo sinh ra được hấp thụ hết vào 500ml dd NaOH 4M. Hãy xác định nồng độ CM của từng chất trong dung dịch thu được sau phản ứng. Coi thể tích dd không thay đổi.
Cho 10,4 gam hỗn hợp hai kim loại kiềm thổ A,B nằm ở 2 chu kỳ liên tiếp trong bảng HTTH tác dụng với 500ml dd HCl 2M. Sau phản ứng thu được dd Y và 6,72 lít khí ở ĐKTC. a. Xác định A,B b. Xác định nồng độ mol/l của các chất trong dd Y (biết thể tích dd Y không thay đổi) c. Cho dd Y tác dụng vừa đủ với 1 lượng Na2CO3. Tính khối lượng kết tủa thu được sau phản ứng.
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 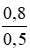
CM (NaOH)dư = 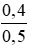
tích cho mình nha![]()
Cho 69,6g MnO2 tác dụng với HCl đặc dư thu được một khí X. Dẫn X vào 500ml dd NaOH 4M (D = 1,25g/ml). Thu được dd A. Tính nồng độ phần trăm các chất có trong dd A. Cho rằng thể tích dd thay đổi không đáng kể. Tính nồng độ mol các chất trong dd A??
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+H_2O\)
Ta có:
\(n_{MnO2}=\frac{69,2}{55+16.2}=0,8\left(mol\right)\)
Theo phản ứng: \(n_{Cl2}=n_{MnO2}=0,8\left(mol\right)\)
Ta có: \(n_{NaOH}=0,5.4=2\left(mol\right)\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}>2n_{Cl2}\Rightarrow\) NaOH dư
\(n_{NaCl}=n_{NaClO}=n_{Cl2}=0,8\left(mol\right)\)
\(n_{NaOH_{Dư}}=2-0,8.2=0,4\left(mol\right)\)
V dung dịch = 500ml = 0,5 lít
\(CM_{NaCl}=CM_{NaClO}=\frac{0,8}{0,5}=1,6M\)
\(CM_{NaOH_{Dư}}=\frac{0,4}{0,5}=0,8M\)
Các bạn giải giúp mình với ạ
Hỗn hợp A gồm Fe, Cu, FeO. Cho m (g) A tác dụng với 200 ml dd HCL được dd B, 0,56l khí và chất rắn D để phản ứng vừa đủ với dd B cần 500 ml dd NaOH 2M. Phản ứng kết thúc thu được kết tủa C. Lọc lấy kết tủa C đem nung nóng đến khi khối lượng không đổi thu được 3,6g chất rắn. Cho D tác dụng với H2SO4 đặc nóng thu được 1,12l khí E. Có dE/H2= 32. Tính m và nồng độ mol của các chất trong dd ban đầu?
cho cac axit :HCLO,HNO3,H2S,H2SO3,HNO2,HCLO4,HMno4.so axit manh la