Trộn 150 ml dung dịch KOH 0,2M với 150 ml dung dịch HCl 0,18M thu được dd A. Tính pH của dung dịch A?

Những câu hỏi liên quan
Trộn 150 ml dung dịch hỗn hợp NaOH 0,2M và KOH 0,2M với 250ml dung dịch HCl 0,4 M thu được dung dịch (X)
a/ Tính nồng độ các ion trong dung dịch (X)
b/ Tính pH của dung dịch (X)a, \(n_{NaOH}=0,15.0,2=0,03\left(mol\right)=n_{Na^+}=n_{OH^-}\)
\(n_{KOH}=0,15.0,2=0,03\left(mol\right)=n_{K^+}=n_{OH^-}\)
⇒ ΣnOH- = 0,03 + 0,03 = 0,06 (mol)
\(n_{HCl}=0,25.0,4=0,1\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(H^++OH^-\rightarrow H_2O\)
0,06____0,06 (mol) ⇒ nH+ dư = 0,1 - 0,06 = 0,04 (mol)
\(\left[Na^+\right]=\left[K^+\right]=\dfrac{0,03}{0,15+0,25}=0,075\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,04}{0,15+0,25}=0,1\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0,1}{0,15+0,25}=0,25\left(M\right)\)
b, pH = -log[H+] = 1
Đúng 2
Bình luận (0)
Trộn ba dung dịch: HCl 0,2M;
H
2
SO
4
0,1M và
HNO
3
0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH x. Giá trị của x là A. 4 B. 1 C. 2 D. 3
Đọc tiếp
Trộn ba dung dịch: HCl 0,2M; H 2 SO 4 0,1M và HNO 3 0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH = x. Giá trị của x là
A. 4
B. 1
C. 2
D. 3
Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
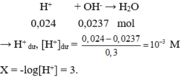
Đúng 0
Bình luận (0)
Bài 2: Trộn lẫn 300ml dung dịch HCl 0,2M với 200ml dung dịch H2SO4 0,05M thu được dung dịch X. Tính pH của dung dịch X. Bài 3:Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.Bài 4: Cho 200 ml dung dịch NaHCO3 1M tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng. Tìm giá trị của m.Bài 5: Hòa tan hết 9,9 gam Zn(OH)2 cần vừa đủ V ml dung dịch HCl 2M. Tìm giá trị của V.
Đọc tiếp
Bài 2: Trộn lẫn 300ml dung dịch HCl 0,2M với 200ml dung dịch H2SO4 0,05M thu được dung dịch X. Tính pH của dung dịch X.
Bài 3:Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.
Bài 4: Cho 200 ml dung dịch NaHCO3 1M tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng. Tìm giá trị của m.
Bài 5: Hòa tan hết 9,9 gam Zn(OH)2 cần vừa đủ V ml dung dịch HCl 2M. Tìm giá trị của V.
Một dung dịch NaOH 0,2m. Lấy 50 ml dung dịch trên đem trộn với 150 ml nước nguyên chất. Tính pH của dung dịch thu được sau khi trộn
\(n_{NaOH}=0.2\cdot0.05=0.01\left(mol\right)\)
\(C_{M_{NaOH\left(ls\right)}}=\dfrac{0.01}{0.05+0.15}=0.05\left(M\right)\)
\(pH=14+log\left(0.05\right)=12.69\)
Đúng 1
Bình luận (0)
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH làVí dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằngVí dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH làVí dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H...
Đọc tiếp
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH là
Ví dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằng
Ví dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH là
Ví dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là
Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH là
Ví dụ 8: Trộn lẫn 2 dd có thể tích bằng nhau của dd HCl 0,2M và dd Ba(OH)2 0,2M. pH của dd thu được là
Ví dụ 9: Trộn hai thể tích dd HCl 0,1M với một thể tích dd gồm NaOH 0,2M và Ba(OH)2 0,15M thu được dd Z có pH là
Ví dụ 10: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 x mol/l thu được 500 ml dd có pH=2. Giá trị của x là
Ví dụ 11: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 a mol/l thu được 500 ml dd có pH=12. Giá trị của a là
Ví dụ 12: Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH bằng
Ví dụ 13: Trung hòa 300 ml dung dịch hỗn hợp HCl và HNO3 có pH=2 cần V ml dung dịch NaOH 0,02M. Giá trị của V là
Ví dụ 14: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
Đúng 3
Bình luận (0)
Ví dụ 3 :
n NaOH = 0,01.0,001V(mol)
n HCl = 0,03.0,001V(mol)
$HCl + NaOH \to NaCl + H_2O$
n HCl dư = 0,03.0,001V - 0,01.0,001V = 0,02.0,001V(mol)
Suy ra :
[H+ ] = CM HCl dư = 0,02.0,001V/0,002V = 0,01(M)
=> pH = -log(0,01) = 2
Đúng 4
Bình luận (0)
Ví dụ 4 :
n HCl = 0,02.0,05 = 0,001(mol)
n H2SO4 = 0,02.0,075 = 0,0015(mol)
=> n H+ = 0,001 + 0,0015.2 = 0,004(mol)
V dd = 0,02 + 0,02 = 0,04(ml)
=> [H+ ] = 0,004/0,04 = 0,1M
=> pH = - log(0,1) = 1
Đúng 4
Bình luận (0)
Trộn 100 ml dung dịch NaOH 0,2M với 400 ml dung dịch Ba(OH)2 0,1M thu được dung dịch A. Tính pH dung dịch A Cho 500 ml dung dịch HCl 0,3 M vào 500 ml dung dịch A thu được dung dịch B. Tính pH dung dịch B
tính pH của dung dịch thu được trong các trường hợp sau
a) trộn lẫn 100ml dung dịch HCL 1M với 100ml dung dịch H2so4 0,5M
b) trộn lãn 50ml dung dịch NAOH 0,2M với 150 ml dung dịch Ba(OH)2 0,2M
c) trộn lẫn 50ml dng dịch HCL 0,12M với 50mldung dịch NaOH 0,1M
d) trộn lẫn 200ml H2SO4 0,05 M với 300ml dd NaOH 0,06M
a) ko bik ....
b) 13,5
c)2
d)2,4
Trộn 250ml dd HCl 0,1M với 150 ml dd H2SO4 0,05M thì thu được dung dịch X . pH của dung dịch X
A. 1 |
B. 0 |
C. 3 |
D. 2 |
\(n_{HCl}=0,1\cdot0,25=0,025mol\)
\(n_{H_2SO_4}=0,05\cdot0,15=0,0075mol\)
\(\Rightarrow n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,04mol\)
\(\Rightarrow C=\dfrac{n}{V}=\dfrac{0,04}{0,25+0,15}=0,1M\)
\(\Rightarrow pH=-log\left(0,1\right)=1\)
Chọn A.
Đúng 1
Bình luận (0)
Trộn lẫn 100 ml dung dịch KOH 0,2M với 100 ml dung dịch HCl 0,1M được dung dịch X. pH của dung dịch X là
A. 12,7
B. 2
C. 12
D. 7
Chọn đáp án A
Phản ứng: KOH + HCl → KCl + H2O
Có nKOH = 0,02 mol; nHCl = 0,01 mol
⇒ sau phản ứng thu được 200 ml dung dịch X gồm 0,01 mol KCl
và 0,01 mol KOH → dung dịch X có môi trường bazơ.
pH = 14 + log([OH−]) = 14 + log(0,01 ÷ 0,2) = 12,7 → chọn đáp án A.
Đúng 0
Bình luận (0)


















