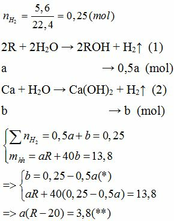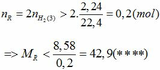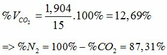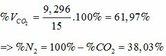Cho 15,75 hỗn hợp 2 kim loại R có hóa trị II và Zn vào dd HCl dư. Khi phản ứng kết thúc thu được dd muối và 8,96 lít khí (đktc). Biết rằng MR > 20.
a)Xác định R.
b)Lấy 8 gam hỗn hợp gồm kim loại R ở trên và Fe cho vào 400ml dd HCl 2M rồi khuấy hỏi kim loại có tan hết không?