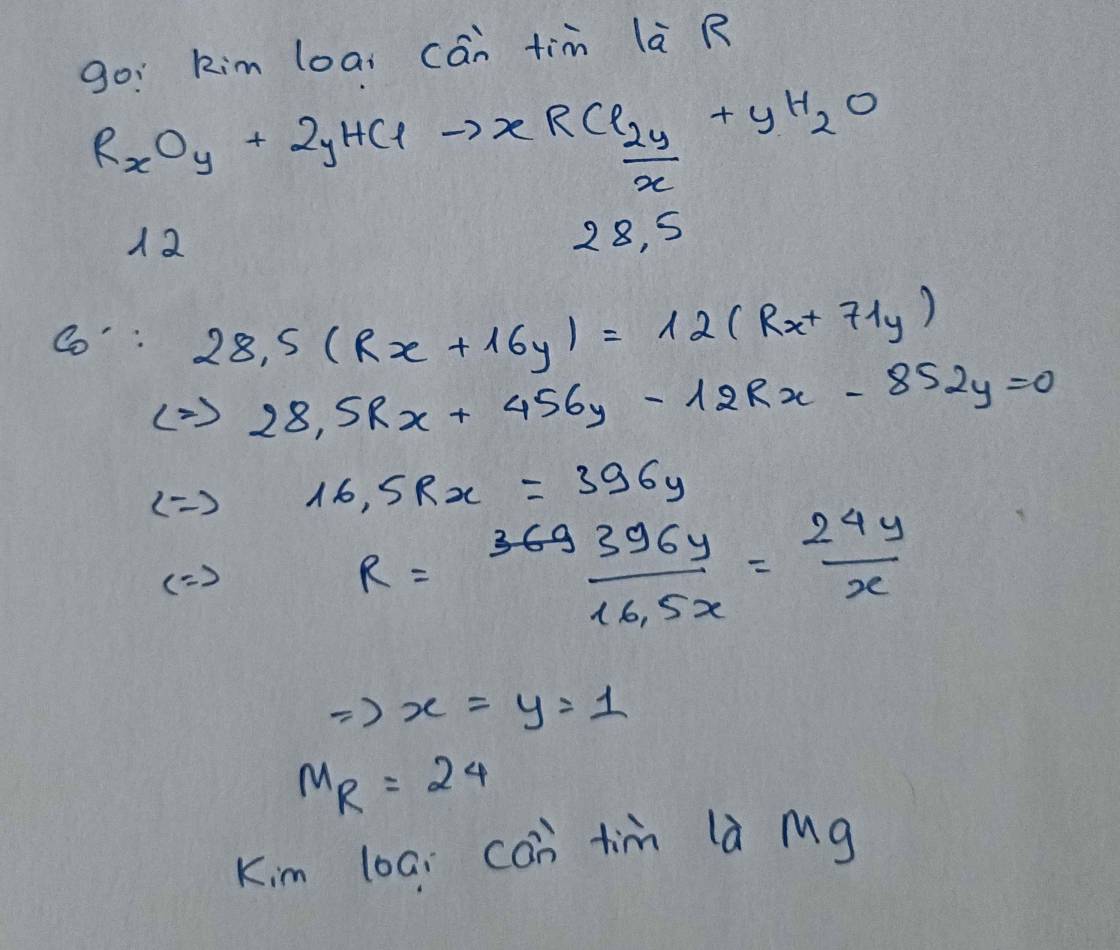cho 12g của 1 oxit của kim loại chưa rõ hóa trị phản ứng vừa đủ với 21,9g HCl. Tìm kim loại

Những câu hỏi liên quan
Cho 7,2g kim loại M chưa rõ hóa trị, phản ứng hoàn toàn cới 21,9g HCl. Xác định tên kim loại đã dùng.
giúp mình với:33
Gọi hóa trị của kim loại M là n
M + nHCl → MCln + n/2H2
nHCl = \(\dfrac{21,9}{36,5}\)= 0,6 mol
nM = \(\dfrac{0,6}{n}\)=> MM = \(\dfrac{7,2n}{0,6}\) = 12n
=> Với n = 2 và MM = 24 g/mol là giá trị thỏa mãn
Kim loại M là Magie (Mg)
Đúng 1
Bình luận (4)
Hòa tan 8 gam oxit của một kim loại ( chưa rõ hóa trị của kim loại ) vào dung dịch chưa a gam HCl ( vừa đủ), phản ứng xong thu được 13,5g muối và nước. Xác định tên kim loại đem dùng. Tính giá trị a.
M2On+2nHCl->2MCln+nH2O
nMCl2=13.5/(MM+35.5*2)
nM2On=8/(2MM+16n)=nMCl2/2
->MM=(1136-216n)/11
vs n=2->MM=64(Cu)
Đúng 0
Bình luận (0)
Cho 12g oxit của kim loại chưa rõ hóa trị tác dụng với dung dịch HCL thu được 28.5g muối.Tìm kim loại
Cho 12g một OXIT kim loại hóa trị II phản ứng hoàn toàn vs 21,9g HCl.Xác định CTHH oxit đó
nHCl = 21,9/36,5 = 0,6 (mol)
PTHH: RO + 2HCl -> RCl2 + H2
nRO = 0,6/2 = 0,3 (mol)
M(RO) = 12/0,3 = 40 (g/mol)
=> R + 16 = 40
=> R = 24
=> R là Mg
Đúng 2
Bình luận (1)
\(n_{HCI}\dfrac{21,9}{36,5}=0,6\left[mol\right]\)
PTHH: RO + 2HCl → RCl2 + H2O
Mol: 0,3 ; 0,6
\(M_{RO}=\dfrac{12}{0,3}=40\left[\dfrac{g}{mol}\right]\)
\(M_R=40-16=24\left[\dfrac{g}{mol}\right]\)
⇒ R là magie
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho 12g một kim loại hóa trị II phản ứng hoàn toàn vs 21,9g HCl.Xác định CTHH oxit đó
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6mol\)
\(R+2HCl\rightarrow RCl_2+H_2\)
0,3 0,6
\(\overline{M_R}=\dfrac{12}{0,3}=40đvC\)
Vậy R là Canxi
CTHH oxit đó là \(CaO\)
Đúng 3
Bình luận (0)
\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6mol\)
Gọi kim loại hóa trị 2 là X
\(X+2HCl\rightarrow\left(t^o\right)XCl_2+H_2\)
1 2 1 1 ( mol )
0,3 0,6 ( mol )
\(M_X=\dfrac{m_X}{n_X}=\dfrac{12}{0,3}=40\) ( g/mol )
=> X là Canxi ( Ca )
Đúng 1
Bình luận (0)
Gọi kim loại hóa trị II là R
\(n_{HCl}=\dfrac{21.9}{36,5}=0,6\left(mol\right)\)
PTHH : R + 2HCl -> RCl2 + H2
0,3 0,6
12
\(M_R=\dfrac{12}{0,3}=40\left(\dfrac{g}{mol}\right)\)
Kim loại đó là Ca
Mà nó tác dụng với Oxit => CTHH : CaO
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Khử 104m4g oxit Kim loại r chưa rõ hoá trị cần vừa đủ vh2 .sau phản ứng thu được 75.6g kim loại tìm kim loại r và giá trị của v
\(n_R=\dfrac{75,6}{M_R}mol\)
\(n_{R_2O_n}=\dfrac{104,4}{2M_R+16n}mol\)
\(R_2O_n+H_2\rightarrow\left(t^o\right)2R+nH_2O\)
\(\dfrac{104,4}{2M_R+16n}\) -----> \(\dfrac{208,8}{2M_R+16n}\) ( mol )
\(\Rightarrow\dfrac{208,8}{2M_R+16n}=\dfrac{75,6}{M_R}\)
\(\Leftrightarrow208,8M_R=151,2M_R+1209,6n\)
\(\Leftrightarrow57,6M_R=1209,6n\)
\(\Leftrightarrow M_R=21n\)
Xét :
n=1 => Loại
n=2 => Loại
n=3 => Loại
\(n=\dfrac{8}{3}\) => R là sắt ( Fe )
Vậy Kim loại đó là sắt ( Fe )
\(\Rightarrow n_{H_2}=\dfrac{75,6}{2.56}=0,675mol\)
\(V_{H_2}=0,675.22,4=15,12l\)
Đúng 3
Bình luận (2)
Cho 0,72g kim loại M chưa rõ hóa trị phản ứng vừa đủ với 1 lượng khí oxi thì thu được 1,2g oxit. Xác định M
Gọi hóa trị kim loại M là n
\(4M + nO_2 \xrightarrow{t^o} 2M_2O_n\\ n_M = 2n_{M_2O_n}\\ \Leftrightarrow \dfrac{0,72}{M} = 2.\dfrac{1,2}{2M + 16n}\\ \Leftrightarrow M = 12n\)
Với n = 2 thì M = 12.2 = 24(Mg)
Vậy M là Magie
Đúng 3
Bình luận (0)
Cho 8g một oxit kim loại hóa trị 2 tan hết trong 200g dd HCl ( vừa đủ và chưa rõ nồng độ). Cô cạn dd sau phản ứng thu được 19g muối a) xác định công thức oxit b) tính nồng độ % của dd HCl cần dùng
lấy 0.91g kim loại chưa rõ hóa trị tác dụng với HCl 10% vừa đủ. sau phản ứng thu được 0.3136 lít hidro. xác định tên kim loại đem ra phản ứng, tính khối lượng dung dịch HCl cần dùng.
Gọi X là kim loại đem ra phản ứng
nH2 = 0,3136/22,4 = 0,014 mol
PTHH: 2X + 2xHCl -> 2XClx + xH2
2mol 2x mol 2 mol x mol
0,028/x <-- 0,028 mol <-- 0,014 mol
=> mX = MX. nX = MX. 0,028/x = 0,91
Do X là kim loại => x thuộc {I; II; III}
x = 1 => MX . 0,028/1 = 0,91 => MX = 32,5 (loại)
x = 2 => MX . 0,028/2 = 0,91 => MX = 65 => X là Zn
x = 3 => MX . 0,028/3 = 0,91 => MX = 97,5 (loại)
Vậy X là kẽm Zn
mHCl = M. n = 36,5. 0,028 = 1,022g
mddHCl = \(\frac{m_{HCl}.100}{C}=\frac{1,022.100}{10}=10,22\)(g)