Cho 22g hỗn hợp Al, Fe vào dung dịch có 0,6 mol HCl. Chứng minh rằng hỗn hợp không tan hết.

Những câu hỏi liên quan
Cho 22 gam hỗn hợp X gồm Al và Fe phản ứng với dung dịch chứa 0,6 mol HCl.Chứng minh hỗn hợp X tan hết
Cho 22 gam hỗn hợp X gồm Al và Fe phản ứng với dung dịch chứa 0,6 mol HCl . Chứng minh hỗn hợp X dư.
PTHH :
Fe+2HCl−−>FeCl2+H2(1)Fe+2HCl−−>FeCl2+H2(1)
2Al+6HCl−−>2AlCl3+3H2(2)2Al+6HCl−−>2AlCl3+3H2(2)
Gỉa sử trong hỗn hợp X chỉ có Fe :
nFe=2256=0,4(mol)⇒nHCl=0,4.2=0,8(mol)nFe=2256=0,4(mol)⇒nHCl=0,4.2=0,8(mol)
nHCl=0,6(mol)<0,8(mol)nHCl=0,6(mol)<0,8(mol)
Chứng tỏ kim loại không tan hết .(1)
Gỉa sử trong hỗn hợp chỉ có Al :
nAl=2227=0,814=>nHCl=3.0,814=2,44(mol)>0,6(mol)nAl=2227=0,814=>nHCl=3.0,814=2,44(mol)>0,6(mol)
Chứng tỏ kim loại không tan hết (2)
Từ (1),(2) chứng tỏ hh X không tan hết .
Đúng 0
Bình luận (0)
Hoàng Nhất Thiên, Chuotconbebong2004, Nguyễn Thành Trương, Phạm Đạt, Toshiro Kiyoshi, Thảo Phương , buithianhtho, muốn đặt tên nhưng chưa nghĩ ra bạn nào tốt nghĩ giùm mk, Nguyen, Diệp Anh Tú, trần hữu tuyển, Hoàng Tuấn Đăng, Nguyễn Trần Thành Đạt, Phùng Hà Châu, Nguyễn Thị Minh Thương , Nguyễn Thị Kiều, Nguyễn Anh Thư, Võ Đông Anh Tuấn, Gia Hân Ngô, Hung nguyen,...
Đúng 0
Bình luận (0)
Cho 22 gam hỗn hợp X gồm Al và Fe phản ứng với dung dịch chứa 0,6 mol HCl.Chứng minh hỗn hợp X tan hết
Giúp mik với
Trộn hỗn hợp X có 0,2 mol K và 0,1 mol Al với 9,3 gam hỗn hợp Y chứa a mol K và b mol Al được hỗn hợp Z. Hỗn hợp Z tan hết trong nước cho dung dịch B. Thêm HCl vào dung dịch B thì ngay giọt đầu tiên dung dịch HCl thêm vào đã có kết tủa. Giá trị của a, b là: A.
n
K
0
,
1
mol
;...
Đọc tiếp
Trộn hỗn hợp X có 0,2 mol K và 0,1 mol Al với 9,3 gam hỗn hợp Y chứa a mol K và b mol Al được hỗn hợp Z. Hỗn hợp Z tan hết trong nước cho dung dịch B. Thêm HCl vào dung dịch B thì ngay giọt đầu tiên dung dịch HCl thêm vào đã có kết tủa. Giá trị của a, b là:
A. n K = 0 , 1 mol ; n Al = 0 , 2 mol
B. n K = 0 , 15 mol ; n Al = 0 , 1 mol
C. n K = 0 , 15 mol ; n Al = 0 , 2 mol
D. n K = 0 , 1 mol ; n Al = 0 , 3 mol
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Đọc tiếp
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B
2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 0,6 mol HCl và 0,14 mol HNO3, thu được dung dịch X (không có ion Fe2+) và x mol khí NO (spkdn). Cho thanh Fe dư vào X thấy thanh sắt giảm 6,44 gam (không thấy khí thoát ra). Giá trị của x là? A. 0,04 B. 0,03 C. 0,06 D. 0,05
Đọc tiếp
Hòa tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4, Fe(OH)2 và Fe(OH)3 trong dung dịch chứa 0,6 mol HCl và 0,14 mol HNO3, thu được dung dịch X (không có ion Fe2+) và x mol khí NO (spkdn). Cho thanh Fe dư vào X thấy thanh sắt giảm 6,44 gam (không thấy khí thoát ra). Giá trị của x là?
A. 0,04
B. 0,03
C. 0,06
D. 0,05
Trộn 8,1 gam Al vói 35,2 gam hỗn hợp X gồm Fe, Fe3O4, FeO, Fe2O3 và Fe(NO3)2 thu được hỗn hợp Y. Hòa tan hết Y vào dung dịch chứa 1,9 mol HCl và 0,15 mol HNO3 để phản ứng hoàn toàn, thu được dung dịch Z (không có
N
H
4
+
) và 0,275 mol hỗn hợp khí T gồm NO và N2O. Cho dung dịch AgNO3 dư vào dung dịch Z đến phản ứng hoàn toàn, thu được dung dịch M; 0,025 mol khí NO (sản phẩm khử duy nhất của N+5) vào 280,75 gam kết tủa. Phần trăm...
Đọc tiếp
Trộn 8,1 gam Al vói 35,2 gam hỗn hợp X gồm Fe, Fe3O4, FeO, Fe2O3 và Fe(NO3)2 thu được hỗn hợp Y. Hòa tan hết Y vào dung dịch chứa 1,9 mol HCl và 0,15 mol HNO3 để phản ứng hoàn toàn, thu được dung dịch Z (không có N H 4 + ) và 0,275 mol hỗn hợp khí T gồm NO và N2O. Cho dung dịch AgNO3 dư vào dung dịch Z đến phản ứng hoàn toàn, thu được dung dịch M; 0,025 mol khí NO (sản phẩm khử duy nhất của N+5) vào 280,75 gam kết tủa. Phần trăm khối lượng Fe(NO3)2 trong Y là:
A. 76,60%.
B. 41,57%.
C. 51,14%.
D. 62,35%.
Số mol Al là: ![]()
Trộn Al và X không có phản ứng hóa học xảy ra ![]()
*Xét giai đoạn dung dịch Z tác dụng với AgNO3 dư:
Dung dịch Z tác dụng với AgNO3 thu được khí NO => Z chứa Fe2+ và H+ (*)
Z chứa Fe2+ và H+ => Z không chứa N O 3 - (**)
Từ (*) và (**) => Dung dịch Z gồm: ![]()
Các phản ứng tạo kết tủa:
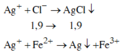
=> Kết tủa: 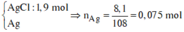
Các quá trình nhường, nhận electron:
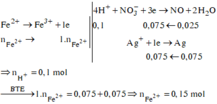
![]()
![]()
![]()
![]()
*Xét giai đoạn Y tác dụng với dung dịch HCl, HNO3:
Sơ đồ phản ứng:
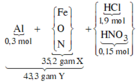
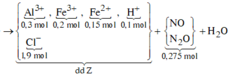
![]()
![]()
![]()
![]()
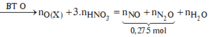
![]()
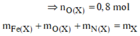
![]()
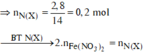
![]()
![]()
Đáp án B.
Đúng 0
Bình luận (0)
Hòa tan hết hỗn hợp rắn X gồm Al, Fe(NO3)2, Fe vào dung dịch chứa 0,5 mol HCl và 0,03 mol NaNO3, thu được dung dịch Y chỉ chứa 25,13 gam các muối (không chứa ion Fe3+) và thoát ra 0,05 mol hỗn hợp khí T có tỉ khối so với H2 bằng 10,6 (trong T có chứa 0,02 mol H2). Dung dịch Y phản ứng tối đa với 0,58 mol NaOH (không có không khí). Phần trăm khối lượng Fe đơn chất có trong X là A. 19,07%. B. 31,78%. C. 25,43%. D. 28,60%.
Đọc tiếp
Hòa tan hết hỗn hợp rắn X gồm Al, Fe(NO3)2, Fe vào dung dịch chứa 0,5 mol HCl và 0,03 mol NaNO3, thu được dung dịch Y chỉ chứa 25,13 gam các muối (không chứa ion Fe3+) và thoát ra 0,05 mol hỗn hợp khí T có tỉ khối so với H2 bằng 10,6 (trong T có chứa 0,02 mol H2). Dung dịch Y phản ứng tối đa với 0,58 mol NaOH (không có không khí). Phần trăm khối lượng Fe đơn chất có trong X là
A. 19,07%.
B. 31,78%.
C. 25,43%.
D. 28,60%.
Hòa tan 15,8g hỗn hợp Al,Mg,Fe vào 500ml dd HCl 2,5M thu được 13,44l khí H2 (đktc) và dung dịch A.Trong hỗn hợp có số mol Mg = số mol Al.Tính % khối lượng kim loại trong hỗn hợp đã hòa tan .Tính khối lượng muối có trong dung dịch A
Gọi $n_{Mg} = n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có :
$24a + 27a + 56b = 15,8(1)$
$n_{HCl} > 2n_{H_2}$ nên HCl dư
Ta có :
$n_{H_2} = a + 1,5a + b = \dfrac{13,44}{22,4} = 0,6(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{Al} = \dfrac{0,2.27}{15,8}.100\% = 34,18\%$
$\%m_{Mg} = \dfrac{0,2.24}{15,8}.100\% = 30,38\%$
$\%m_{Fe} = 35,44\%$
$n_{HCl\ pư} = 2n_{H_2} = 1,2(mol)$
Bảo toàn khối lượng : $m_{muối} = 15,8 + 1,2.36,5 - 0,6.2 = 58,4(gam)$
Đúng 1
Bình luận (0)














