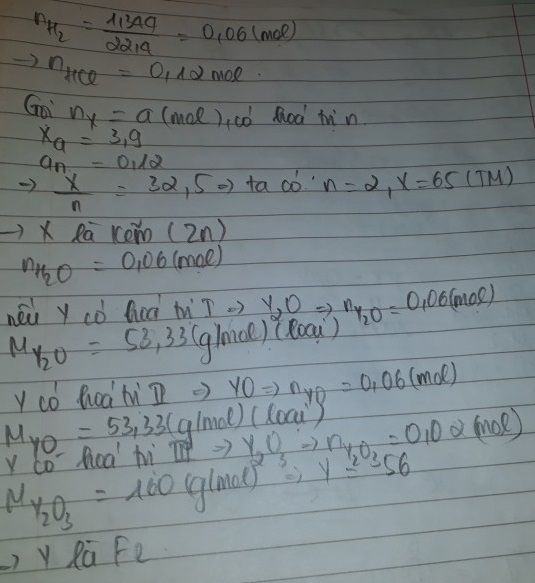6. Để hòa tan hoàn toàn 8g oxit kim loại R cần dùng 300ml dung dịch HCl 1M. Hỏi R là kim loại gì?

Những câu hỏi liên quan
Hòa tan hoàn toàn 8g một oxit kim loại R cần dùng dung dịch chứa 0,3 mol HCl. Xác định kim loại R và oxit nói trên
Gọi công thức của oxit kim loại R là R2On
Phương trình phản ứng : R2On + 2nHCl → 2RCln + nH2O
==> nR2On = \(\dfrac{0,3}{2n}\) mol ==> MR2On = 8: \(\dfrac{0,3}{2n}\) = \(\dfrac{16n}{0,3}\)
Thử n =1 ; 2 ; 3 thấy n=3 thỏa mãn MOxit = 160
=> MR = \(\dfrac{160-16.3}{2}\) = 56 ( Fe)
Vậy kim loại R là Fe và oxit kim loại có công thức Fe2O3
Đúng 1
Bình luận (0)
a) để hòa tan hoàn toàn 8 g oxit một kim loại R cần dùng 10,95 g HCl .hỏi R là kim loại gì ?
b) hòa tan hoàn toàn 1,44 g kim loại hóa trị 2 bằng dung dịch H2SO4 loãng chứa 7,35 g H2SO4 để phản ứng hết lượng dư axit người ta phải dùng 1,3 g NaOH sau phản ứng thu được muối Natrisunjat và nước . viết PTHH và xác định kim loại đem dùng
a) CT : R2On
nHCl = 10.95/36.5 = 0.3 (mol)
R2On + 2nHCl => 2RCln + nH2O
0.15/n_____0.3
M= 8/0.15/n = 160n/3
=> 2R + 16n = 160n3
=> 2R = 112n/3
BL : n 3 => R = 56
R là : Fe
b)2NaOH + H2SO4 => Na2SO4 + H2O
nH2SO4(bđ) = 7.36/98 = 0.075 (mol)
nNaOH = 1.3/40 = 0.0325 (mol)
=> nH2SO4(pư) = 0.075 - 0.0325/2 = 0.05875 (mol)
R + H2SO4 => RSO4 + H2
0.05875_0.05875
M = 1.44/0.05875= 24
R là : Mg
Chúc bạn học tốt !!!
Đúng 2
Bình luận (0)
Câu 1: Để hoà tan hoàn toàn 8g oxit kim loại A cần dùng 300ml dung dịch HCl 1M. Xác định oxit kim loại A
Mong các bạn giải chi tiết bài này hộ mình nhá. Mình cảm ơn trước luôn nha !!!!!!!!!!!!
gọi KL là A có hoá trị là x
--> CTHH của oxit là: A2Ox
--> VddHCl = 300ml = 0,3l --> nHCL= 0,3.1= 0,3 mol
PT: A2Ox +2x HCl----->2 AClx +x H2O
8/(2A+16x)--0,3
ta có pt toán: 16x/(2A+16x) = 0,3
=> 3A = 56x
biện luận kết quả ta đc
nếu x=I => A= 56/3 loại
nếu x=II => A= 112/3 loại
nếu x=III=> A= 56 chọn
vậy KL A là Fe(sắt) có hoá trị III => CTHH của oxit: Fe2O3
Đúng 0
Bình luận (1)
Để hòa tan hoàn toàn 6,4 gam hỗn hợp kim loại R (chỉ có hóa trị II) và oxit của nó cần vừa đủ 400ml dung dịch HCl 1M. Tìm kim loại R
A. Ca
B. Mg
C. Ba
D. Be
Đáp án B
R + HCl → RCl2 + H2
RO + 2HCl → RCl2 + H2O
Ta có: nHCl =0,4.1 = 0,4 mol → ![]() = 0,2 mol →
= 0,2 mol → ![]() = 32
= 32
Theo tính chất của ![]() ta có: M < 32 < M + 16 → 16 < M < 32
ta có: M < 32 < M + 16 → 16 < M < 32
→ M = 24 (Mg) là nghiệm hợp lí
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 1g oxit của kim loại R cần dùng 25ml dung dịch gồm hỗn hợp H2SO4 và axit HCl 1M . Tính công thức hóa học của oxit trên
Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là
A. Ba
B. Ca
C. Be
D. Mg
Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là: A. Be B. Ca C. Ba D. Mg
Đọc tiếp
Để hoà tan hoàn toàn 6,4 gam hỗn hợp gồm kim loại R (chỉ có hoá trị II) và oxit của nó cần vừa đủ 400 ml dung dịch HCl 1M. Kim loại R là:
A. Be
B. Ca
C. Ba
D. Mg
Ta có nR = x, nRO = y.
R(x+y)+16y=6,4.
x+y=0,2.
=> 16<R<32.
=> R là magie
=> Đáp án D
Đúng 0
Bình luận (0)
1/ Hòa tan hoàn toàn 5,1g một oxít kim loại hóa trị III cần dùng 300ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X. a) Xác định tên của kim loại. b) Tính nồng độ mol của dung dịch sau phản ứng
Đọc tiếp
1/ Hòa tan hoàn toàn 5,1g một oxít kim loại hóa trị III cần dùng 300ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X. a) Xác định tên của kim loại. b) Tính nồng độ mol của dung dịch sau phản ứng
a. CT oxit : \(R_2O_3\)
\(R_2O_3+6HCl\rightarrow2RCl_3+3H_2O\\ n_R=\dfrac{1}{6}n_{HCl}=\dfrac{0,3}{6}=0,05\left(mol\right)\\ M_{R_2O_3}=2R+16.3=\dfrac{5,1}{0,05}=102\\ \Rightarrow R=27\left(Al\right)\\ b.n_{AlCl_3}=\dfrac{1}{3}n_{HCl}=0,1\left(mol\right)\\ \Rightarrow CM_{AlCl_3}=\dfrac{0,1}{0,3}=0,33M\)
Đúng 2
Bình luận (0)
nHCl = 0,3.1=0,3(mol)
PTHH: A2O3 + 6HCl --> 2ACl3 + 3H2O
_____0,05<---0,3--------->0,1___________(mol)
=> \(M_{A_2O_3}=\dfrac{5,1}{0,05}=102\left(g/mol\right)\)
=> MA = 27 (g/mol) => A là Al
b) \(C_{M\left(AlCl_3\right)}=\dfrac{0,1}{0,3}=0,33M\)
Đúng 1
Bình luận (0)
Để hòa tan 3,9 g kim loại X cần dùng V ml dung dịch HCl và thu được 1,344 lít khí H2 (đktc). Mặt khác để hòa tan 3,2 g oxit của kim loại Y cũng cần dùng V ml dung dịch HCl trên. Hỏi X,Y là kim loại gì?
- Thí nghiệm 1: Gọi hóa trị của X là n
CÓ n H2 = 0,06 ( mol ) => n HCL = 0,12 ( mol )
PTHH: 2X +2n HCL ===> 2XCLn + nH2
theo pthh: n X = 0,12/n ( mol )
=> X = 32,5n
Xét: n = 2 => X = 65 ( Zn )
- Thí nghiệm 2
Gọi CT của oxit : YaOb
PTHH
\(YaOb+2bHCL\rightarrow aYCl_{\dfrac{2b}{a}}+bH2O\)
theo pthh: n YaOb = 0,06/b ( mol )
=> aY + 16b = 160/3 . b
=> Y = 56 . 2b/a
Xét: 2b/a = 3 => Y = 56 ( Fe )
Đúng 1
Bình luận (0)