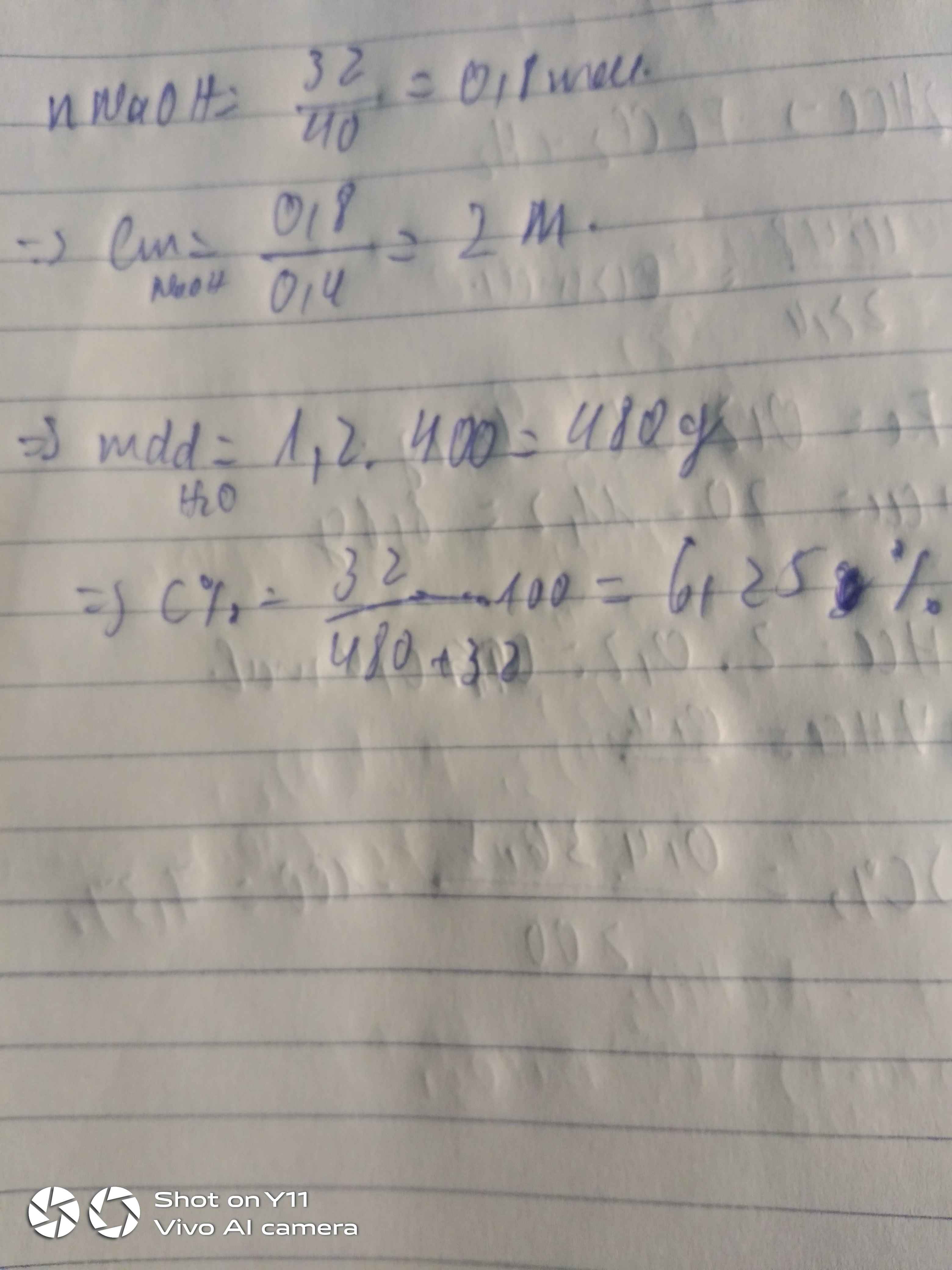3. Một dung dịch NaOH có nồng độ 5%, d=1,2g/ml. Tính nồng độ mol/l của dung dịch NaOH nói trên

Những câu hỏi liên quan
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Bài 1. Tính nồng độ mol của dung dịch NaOH 20% với D = 1,225 g/ml.
Bài2. Tính nồng độ % của dung dịch HCl 4,73M có D = 1,079 g/ml.
Bài 1. \(C_M=\dfrac{10.D.C\%}{M}=\dfrac{10.1,225.20}{40}=6,125M\)
Bài 2: \(C_M=\dfrac{10.D.C\%}{M}\Leftrightarrow4,73=\dfrac{10.1,079.C\%}{36,5}\)
=> \(C\%=16\%\)
Đúng 2
Bình luận (0)
Hình như câu 1 thiếu dữ kiện em ơi,câu 2 cũng vậy
Đúng 0
Bình luận (1)
Cho 200 ml dung dịch NaOH phản ứng hoàn toàn với 350 ml dung dịch H2SO4 2M
a) Tính nồng độ mol/lit của dung dịch NaOH ban đầu?
b) Tính nồng độ mol/lit của dung dịch sau phản ứng?
a) $n_{H_2SO_4} = 0,35.2 = 0,7(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Theo PTHH :
$n_{NaOH} = 2n_{H_2SO_4} = 1,4(mol) \Rightarrow C_{M_{NaOH}} = \dfrac{0,7}{0,2} = 3,5M$
b) $V_{dd\ sau\ pư} = 0,2 + 0,35 = 0,55(lít)$
$C_{M_{Na_2SO_4}} = \dfrac{0,7}{0,55} = 1,27M$
Đúng 2
Bình luận (0)
Trộn lẫn 150 ml dung dịch NaOH 0,5M với 50 ml dung dịch Ba(OH)2 2M. Tính nồng độ mol/l của các ion trong dd thu được.
Tính số mol của NaOH, Ba(OH)2.
2) Tính nồng độ mol của NaOH, Ba(OH)2 sau khi trộn (vì V đã thay đổi.)
3) Viết PTĐL. 4) Tính nồng độ mol của các ion dựa vào PTĐL
Cho 50g dung dịch Cu(NO\(_3\))\(_2\) 5% tác dụng với 60ml dung dịch NaOH (D=1,2g/ml)
a) Tính nồng độ mol, nồng độ phần trăm của dung dịch NaOH phản ứng
b) Tính khối lượng kết tủa thu được
c) Tính nồng độ phần trăm của dung dịch sau phản ứng
PT: \(Cu\left(NO_3\right)_2+2NaOH\rightarrow2NaNO_3+Cu\left(OH\right)_{2\downarrow}\)
a, Ta có: \(m_{Cu\left(NO_3\right)_2}=\frac{50.5\%}{100\%}=2,5\left(g\right)\)
\(\Rightarrow n_{Cu\left(NO_3\right)_2}=\frac{2,5}{188}=\)
Tới đây tính ra số mol Cu(NO3)3 lẻ quá, không biết đề có nhầm lẫn ở đâu không bạn nhỉ?
PTHH: \(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+2NaNO_3\)
a) Ta có: \(m_{Cu\left(NO_3\right)_2}=50\cdot5\%=2,5\left(g\right)\) \(\Rightarrow n_{Cu\left(NO_3\right)_2}=\frac{2,5}{188}=\frac{5}{376}\left(mol\right)\)
\(\Rightarrow n_{NaOH}=\frac{5}{188}\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaOH}}=\frac{\frac{5}{188}}{0,06}\approx0,44\left(M\right)\\m_{NaOH}=\frac{5}{188}\cdot40=\frac{50}{47}\left(g\right)\end{matrix}\right.\)
Theo đề bài: \(m_{ddNaOH}=60\cdot1,2=72\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\frac{\frac{50}{47}}{72}\cdot100\approx1,48\%\)
b) Theo PTHH: \(n_{Cu\left(NO_3\right)_2}=n_{Cu\left(OH\right)_2}=\frac{5}{376}\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=\frac{5}{376}\cdot98\approx1,3\left(g\right)\)
c) Theo PTHH: \(n_{NaOH}=n_{NaNO_3}=\frac{5}{188}\left(mol\right)\) \(\Rightarrow m_{NaNO_3}=\frac{5}{188}\cdot85\approx2,26\left(g\right)\)
Mặt khác: \(m_{dd}=m_{Cu\left(NO_3\right)_2}+m_{NaOH}-m_{Cu\left(OH\right)_2}=50+72-1,3=120,7\left(g\right)\)
\(\Rightarrow C\%_{NaNO_3}=\frac{2,26}{120,7}\cdot100\approx1,87\%\)
Đúng 0
Bình luận (0)
cho 15.5gam Naoh vào nước. Thu được 0.5 lít dung dịch kiềm
a)tính nồng độ mol của dung dịch kiềm.
B)tính thể tích dung dịch H2So4 20% ( D=1.14gam/ml) để trung hoà dung dịch kiềm nói trên.
a) $n_{NaOH} = \dfrac{15,5}{40} = 0,3875(mol)$
$C_{M_{NaOH}} = \dfrac{0,3875}{0,5} =0,775M$
b)
$2NaOH + H_2SO_4 \to Na_2SO_4 + H_2$
$n_{H_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,19375(mol)$
$m_{dd\ H_2SO_4} =\dfrac{0,19375.98}{20\%} = 94,9375(gam)$
$V_{dd\ H_2SO_4} = \dfrac{94,9375}{1,14} = 83,28(ml)$
Đúng 1
Bình luận (0)
3. Cho 1,12g Fe vào 200 ml dung dịch CuSO4 0,1M (d=1,2g/ml)
a) Viết PTHH
b) Tính nồng độ phần trăm (C%). Nồng độ mol/l ,(CM của dung dịch ). Biết thể tích dung dịch sau phản ứng thay đổi không đáng kể.
\(n_{Fe}=\dfrac{1,12}{56}=0,02(ml)\\n_{CuSO_4}=0,2.0,1=0,02(mol)\\ m_{dd_{CuSO_4}}=1,2.200=240(g)\\ a,PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ LTL:\dfrac{0,02}{1}=\dfrac{0,02}{1}\Rightarrow \text{p/ứ hoàn toàn}\\ \Rightarrow n_{FeSO_4}=n_{Cu}=0,02(mol)\\ b,C\%_{FeSO_4}=\dfrac{0,02.152}{1,12+240-0,02.64}.100\%=1,27\%\\ C_{M_{FeSO_4}}=\dfrac{0,02}{0,2}=0,1M\)
Đúng 2
Bình luận (0)
Chọn đáp án A
NST số 1 giảm phân tạo giao tử: 1/2 bình thường, 1/2 đột biến
Các NST khác giảm phân bình thường tạo giao tử bình thường
→ Một thể đột biến trong đó cặp NST số 1 có 1 chiếc bị mất đoạn, khi giảm phân nếu các NST phân li bình thường thì trong số các loại giao tử được tạo ra giao tử không mang NST đột biến có tỉ lệ: ½
Đúng 0
Bình luận (0)
Trong 120g dung dịch NaOH 15% của D:1,2g/cm3.Tìm nồng độ mol của dung dịch NaOH trên.
\(m_{NaOH}=\frac{120.15\%}{100}=18\left(g\right)\) => \(n_{NaOH}=\frac{18}{40}=0,45\left(mol\right)\)
\(V_{dd}=\frac{120}{1,2}=100\left(ml\right)=0,1\left(l\right)\)
=> \(C_M=\frac{0,45}{0,1}=4,5M\)
Đúng 0
Bình luận (0)
Trộn 200ml dd NaOH 1M vào 300 ml dd H2SO4 1,5M thu được dd D.
a. Tính nồng độ mol/lít các chất trong dung dịch D.
b. Tính thể tích dd Ca(OH)2 10% (d=1,2g/mL) để trung hoà dung dịch D.
\(n_{NaOH}=0,2.1=0,2\left(mol\right)\\ n_{H_2SO_4}=0,3.1,5=0,45\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2------->0,1--------->0,1
Xét \(\dfrac{0,2}{2}< \dfrac{0,45}{1}\Rightarrow\) \(H_2SO_4\)dư
Trong dung dịch D có:
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,45-0,1=0,35\left(mol\right)\\n_{Na_2SO_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{H_2SO_4}=\dfrac{0,35}{0,5}=0,7M\\CM_{Na_2SO_4}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
b
\(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
0,35<---------0,35
\(V_{Ca\left(OH\right)_2}=\dfrac{0,35.74}{1,2}=\dfrac{259}{12}\approx21,58\left(ml\right)\\ \Rightarrow V_{dd.Ca\left(OH\right)_2}=\dfrac{\dfrac{259}{12}.100\%}{10\%}=\dfrac{1295}{6}\approx215,83\left(ml\right)\)
Đúng 2
Bình luận (0)