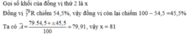Trong tự nhiên Br có 2 đồng vị, trong đó 79Br chiếm 54,5% . Hãy tìm số khối của mỗi đồng vị

Những câu hỏi liên quan
Trong tự nhiên Br có 2 đồng vị là 79Br, 81Br. Biết 79Br chiếm 54,5% số nguyên tử. Tìm khối lượng nguyên tử trung bình của Br. A. 79,91. B. 80,09. C. 80,72. D. 79,10.
Đọc tiếp
Trong tự nhiên Br có 2 đồng vị là 79Br, 81Br. Biết 79Br chiếm 54,5% số nguyên tử. Tìm khối lượng nguyên tử trung bình của Br.
A. 79,91.
B. 80,09.
C. 80,72.
D. 79,10.
Đáp án A
Khối lượng nguyên tử trung bình của Br là
MBr = ( 79 . 54 , 5 + 81 ( 100 - 54 , 5 ) ) / 100 = 79 , 91
Đúng 0
Bình luận (0)
Brom có hai đồng vị , trong đó đồng vị 79Br chiếm 54,5% . Xác định đồng vị còn lại , biết M Br=79,91
\(\overline{A}=\dfrac{79.54,5\%+A_2.\left(100\%-54,5\%\right)}{100\%}=79,91\Rightarrow A_2=81\)
Đồng vị còn lại là : 81Br
Đúng 2
Bình luận (2)
Trong tự nhiên Brom có 2 đồng vị bền: 79Br chiếm 50,69% số nguyên tử và 81Br chiếm 49,31% số nguyên tử. Hãy tìm nguyên tử khối trung bình của brom.
Nguyên tử khối của Brom là :
\(\overline{A}=\frac{79.50,69+81.49,31}{100}\approx79,98u\)
Vậy Nguyên tử khối trung bình của Brom là \(79,98u\)
Đúng 1
Bình luận (0)
Nguyên tử khối trung bình của Br là:
\(\overline{A}=\frac{79.50,69+81.49,31}{50,69+49,31}=\frac{7998,62}{100}=79,9862\)
Vậy nguyên tử khối trung bình của Br là 79,9862
Đúng 0
Bình luận (1)
Nguyên tử khối trung bình của nguyên tố R là 79,91. Trong tự nhiên R có 2 đồng vị bền. Biết đồng vị
R
7
79
chiếm 54,5%. Số khối của đồng vị thứ hai là: A. 80 B. 81 C. 82 D. 83
Đọc tiếp
Nguyên tử khối trung bình của nguyên tố R là 79,91. Trong tự nhiên R có 2 đồng vị bền. Biết đồng vị R 7 79 chiếm 54,5%. Số khối của đồng vị thứ hai là:
A. 80
B. 81
C. 82
D. 83
Trong tự nhiên kali gồm 3 đồng vị 39K chiếm 93,26% và đồng vị 40K chiếm 0,012% và đồng vị 41K. Brom là hỗn hợp hai đồng vị 79Br và 81Br với nguyên tử khối trung bình của Br là 79,92. Thành phần % khối lượng của 39K trong KBr là A. 30,56%. B. 29,92%. C. 31,03%. D. 30,55%.
Đọc tiếp
Trong tự nhiên kali gồm 3 đồng vị 39K chiếm 93,26% và đồng vị 40K chiếm 0,012% và đồng vị 41K. Brom là hỗn hợp hai đồng vị 79Br và 81Br với nguyên tử khối trung bình của Br là 79,92. Thành phần % khối lượng của 39K trong KBr là
A. 30,56%.
B. 29,92%.
C. 31,03%.
D. 30,55%.
Đáp án D
%41K = 100 - 93,26 - 0,012 = 6,728%.
Khối lượng nguyên tử trung bình của K là:
MK = 39 x 0,9326 + 40 x 0,00012 + 41 x 0,06728 = 39,13468.
Khối lượng nguyên tử trung bình của Br là:
MBr = 79,92.
Thành phần phần trăm của 39K trong KBr là
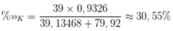
Đúng 0
Bình luận (0)
Câu 1. Trong tự nhiên brom có hai đồng vị, đồng vị 79Br chiếm 54% số nguyên tử và nguyên tử khối trung bình của brom là 79,92. Xem nguyên tử khối có giá trị bằng số khối thì đồng vị thứ hai có số khối làA. 82. B. 83. C. 80. D. 81.
Đọc tiếp
Câu 1. Trong tự nhiên brom có hai đồng vị, đồng vị 79Br chiếm 54% số nguyên tử và nguyên tử khối trung bình của brom là 79,92. Xem nguyên tử khối có giá trị bằng số khối thì đồng vị thứ hai có số khối là
A. 82. B. 83.
C. 80. D. 81.
Phần trăm số nguyên tử đồng vị còn lại là 100% -54% = 46%
Gọi A là số khối đồng vị còn lại
Ta có :
$A.46\% + 79.54\% = 79,92 \Rightarrow A = 81$
Đáp án D
Đúng 1
Bình luận (0)
Tính nguyên tử khối trung bình của các nguyên tố. Biết rằng trong tự nhiên, đồng vị của các nguyên tố này tồn tại theo số liệu sau:
b. Ne có 2 đồng vị: (91%) và
c. Br có 2 đồng vị 79 Br (54,5%) và 81 Br
Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%. Thành phần % khối lượng của 56Fe trong FeBr3 là A. 17,36%. B. 18,92%. C. 27,03%. D. 27,55%.
Đọc tiếp
Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%.
Thành phần % khối lượng của 56Fe trong FeBr3 là
A. 17,36%.
B. 18,92%.
C. 27,03%.
D. 27,55%.
Đáp án A
• Khối lượng nguyên tử trung bình của Fe là
MFe = 0,058 x 54 + 0,9172 x 56 + 0,022 x 57 + 0,0028 x 58 = 55,9116.
Khối lượng trung bình của Br là
MBr = 0,5069 x 79 + 0,4931 x 81 = 79,9862.
Phần trăm khối lượng của 56Fe trong FeBr3 là
![]()
Đúng 0
Bình luận (0)
hóa học 10 tính nguyên tử khối của đồng vị còn lại nếu biết nguyên tử khối trung bình của nguyên tố X là 79,91. biết X có hai đồng vị trong đó đồng vị 79X chiếm 54,5% số nguyên tử
Đặt x nguyên tử khối của đồng vị còn lại
Ta có : \(\overline{M}=\dfrac{54,5.79+\left(100-54,5\right).x}{100}=79,91\)
\(\rightarrow x=81\)
Vậy nguyên tử khối của đồng vị còn lại : \(^{81}X\)
Đúng 2
Bình luận (0)