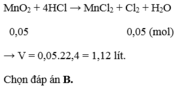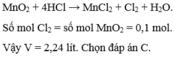6/ Cho 12 gam Mg tác dụng với 500ml dung dịch HCl 0,02M. Thể tích khi thoát ra ở đktc là bao nhiêu?

Những câu hỏi liên quan
Tính thể tích khí H2 ở điều kiện tiêu chuẩn khi cho 4,8 gam Mg tác dụng với 500ml dung dịch HCl 1M
$n_{Mg} = \dfrac{4,8}{24} = 0,2(mol) ; n_{HCl} = 0,5(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Ta thấy :
$n_{Mg} : 1 < n_{HCl} : 2$ nên HCl dư
$n_{H_2} = n_{Mg} = 0,2(mol) \Rightarrow V_{H_2} = 0,2.22,4 = 4,48(lít)$
Đúng 2
Bình luận (0)
cho 44,5 gam hổn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 4,48lít khí thoát ra ở đktc và dung dịch X . cô cạn dung dịch X thì thu được bao nhiêu gam muối khan ?
Cho 4,35 gam M n O 2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít.
B. 1,12 lít.
C. 2,24 lít.
D. 0,112 lít.
Cho 8,7 gam M n O 2 tác dụng với lượng dư dung dịch HCl đặc, đun nóng. Thể tích khí thoát ra (ở đktc) là
A. 0,56 lít.
B. 1,12 lít.
C. 2,24 lít.
D. 0,112 lít.
Cho hỗn hợp A gồm Fe và Mg (tỉ lệ mol 1:2) tác dụng với dung dịch HCl dư, thấy thoát ra 6,72 lít khí (đktc). Khi cô cạn dung dịch thu được bao nhiêu gam muối?
A. 31,7 gam
B. 36 gam
C. 27,4 gam
D. 24 gam
Đặt x là số mol Fe => 2x là số mol Mg
PTHH: Fe +2 HCl -> FeCl2 + H2
Mg + 2 HCl -> MgCl2 + H2
Ta có: nH2(tổng)=nFe+nMg=3x(mol)
<=> 0,3=3x
<=>x=0,1
=> m(muối)= mFeCl2 + mMgCl2 = 0,1. 127+ 0,2.95= 31,7(g)
=> CHỌN A
Đúng 2
Bình luận (0)
Cho 4,8g Mg tác dụng vừa đủ với 100g dung dịch HCl. Hãy tính: a Thể tích H2 thoát ra ở đktc b Nồng độ % của dung dịch axit HCl đã dùng ( Cho biết O = 16;H = 1;Mg = 24;Cl = 35,5)
a, Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\)
Đúng 2
Bình luận (0)
Để giải bài toán này, ta cần viết phương trình phản ứng giữa Mg và HCl:
$$\text{Mg} + 2\text{HCl} \rightarrow \text{MgCl}2 + \text{H}2$$
Theo đó, 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2. Ta có thể tính số mol Mg trong 4,8g Mg như sau:
$$n{\text{Mg}} = \frac{m{\text{Mg}}}{M_{\text{Mg}}} = \frac{4,8}{24} = 0,2 \text{mol}$$
Vì 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2, nên số mol HCl cần để tác dụng với 0,2 mol Mg là 0,4 mol. Từ đó, ta có thể tính khối lượng HCl cần dùng như sau:
$$m_{\text{HCl}} = n_{\text{HCl}} \times M_{\text{HCl}} = 0,4 \times 36,5 = 14,6 \text{g}$$
Vậy, dung dịch HCl có nồng độ $c = \frac{m_{\text{HCl}}}{V_{\text{HCl}}}$, trong đó $V_{\text{HCl}}$ là thể tích dung dịch HCl đã dùng. Để tính thể tích HCl đã dùng, ta cần biết nồng độ của dung dịch axit HCl đã dùng. Ta có thể tính nồng độ % của dung dịch axit HCl như sau:
$$\text{nồng độ %} = \frac{m_{\text{HCl}}}{m_{\text{dung dịch}}} \times 100%$$
Trong đó, $m_{\text{dung dịch}}$ là khối lượng của dung dịch HCl đã dùng. Từ đó, ta có thể tính được thể tích dung dịch HCl đã dùng và thể tích H2 thoát ra ở đktc như sau:
\begin{align*}
m_{\text{dung dịch}} &= \frac{m_{\text{HCl}}}{\text{nồng độ %}} = \frac{14,6}{36,5} \times 100% = 40\text{g} \
V_{\text{HCl}} &= \frac{m_{\text{HCl}}}{c_{\text{HCl}}} = \frac{14,6}{0,365} = 40\text{mL} \
V_{\text{H}2} &= n{\text{H}2} \times V{\text{m}} = 0,1 \times 24,45 = 2,445\text{L}
\end{align*}
Vậy, thể tích H2 thoát ra ở đktc là 2,445 L.
Đúng 1
Bình luận (1)
Cho 8 gam hỗn hợp bột kim loại Mg và Fe tác dụng hết với dung dịch HCl thấy thoát ra 5,6 lít khí ở đktc. Khối lượng muối tạo ra trong dung dịch là
A. 22,25 gam.
B. 22,75 gam.
C. 25,75 gam.
D. 24,45 gam.
Đáp án C
Bảo toàn nguyên tố Hidro và Clo:
![]() .
.
![]()
![]()
Đúng 0
Bình luận (0)
Cho 8 gam hỗn hợp bột kim loại Mg và Fe tác dụng hết với dung dịch HCl thấy thoát ra 5,6 lít khí ở đktc. Khối lượng muối tạo ra trong dung dịch là
A. 22,25 gam.
B. 22,75 gam
C. 25,75 gam
D. 24,45 gam
Cho 8 gam hỗn hợp bột kim loại Mg và Fe tác dụng hết với dung dịch HCl thấy thoát ra 5,6 lít khí ở đktc. Khối lượng muối tạo ra trong dung dịch là
A. 22,25 gam.
B. 22,75 gam.
C. 25,75 gam.
D. 24,45 gam.
Đáp án C
Bảo toàn nguyên tố Hidro và Clo: ![]()
=> mmuối = ![]()
=> Chọn C
Đúng 0
Bình luận (0)