Tính thể tích cần thêm vào để pha loãng 100ml d HCl 0,1M thành d HCl có pH=2
đem 100ml dung dịch A gồm H2SO4 0,1M và HCl 0,3M với 300ml dung dịch bari hidroxit aM.thì thu được dung dịch có pH=13. tính a
tính thể tích dung dịch KOH 0,001M cần pha loãng với nước để được dung dịch có pH=9......nH+ = 0,1*0.1*2+0.3*0.1=0.05mol
vì pH=13--->pOH=1---> nOH- dư =0.1mol
H+ + OH- --->H2O
từ các dung dịch hcl 36 % (d = 1,18g/ml ) , H2So4 96% ( d = 1,84g/mL)
. pha 100mL dung dịch HCL 0,1M
. pha 100ml dung dịch h2so4 0.05M
b. Từ tinh thể NaOH 96% hãy tính pha 100ml NaOH 25%
Tính thể tích dd acid clohidric 37,23% (d=1,19) cần để pha 100ml dd HCl 10% (khối lượng/thể tích)
\(m_{ddHCl\left(10\%\right)}=100.1,19=119g\\ m_{HCl}=119.10\%=1190g\\ m_{ddHCl\left(37,23\%\right)}=\dfrac{1190}{37,23}=32g\)
\(\Rightarrow V_{HCl}=32:1,19:1,19=22,6ml\)
Cần thêm bao nhiêu ml dung dịch HCl 0,15M vào 100ml dung dịch hỗn hợp gồm hai bazo NaOH 0,1M + Ba(OH)2 0,075M để thu được dung dịch có pH=2?
A. 13/70 lít
B. 15/70 lít
C. 0,65 lít
D. 1 lít
Đáp án A
nHCl = 0,15V mol = nH+
nOH-= 0,1.0,1+ 0,075.2.0,1 = 0,025 mol
Dung dịch thu được sau phản ứng có pH = 2 nên axit dư
H+ + OH- → H2O
0,025 0,025mol
nH+ dư = 0,15V- 0,025 mol
[H+] dư = nH+ dư/ Vdd = (0,15V- 0,025)/(V+0,1) = 10-2 suy ra V = 13/70 lít
Dung dịch HCl có pH =3. Pha loãng dung dịch bằng cách thêm vào 90ml nước cất thì dung dịch mới
có pH=4.Tính thể tích dung dịch trước khi pha loãng.
A. 10ml
B. 910ml
C. 100ml
D. Kết quả khác
Câu hỏi:
Dung dịch HCl có pH =3. Pha loãng dung dịch bằng cách thêm vào 90ml nước cất thì dung dịch mới
có pH=4.Tính thể tích dung dịch trước khi pha loãng.
A. 10ml
B. 910ml
C. 100ml
D. Kết quả khác
\(pH=3\Rightarrow\left[H^+\right]=10^{-3}\Rightarrow n_{H^+}=10^{-3}.V\)
\(pH=4\Rightarrow\left[H^+\right]=10^{-4}\Rightarrow n_{H^+}=10^{-4}.\left(V+0,09\right)\)
\(\Rightarrow n_{H^+}=10^{-3}.V=10^{-4}.\left(V+0,09\right)\)
\(\Leftrightarrow V=0,01\left(l\right)=10ml\)
1 Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4 ?
2 Pha loãng dung dịch 1 lít NaOH có pH = 9 bằng nước để được dung dịch mới có pH = 8. Thể tích nước cần dùng là?
Câu 1 :
Gọi thể tích dung dịch ban đầu là V(lít)
$[H^+] = 10^{-3}V(mol)$
Thể tích dung dịch lúc sau là :
$V' = \dfrac{10^{-3}.V}{10^{-4}} = 10V$
Do đó cần pha loãng dung dịch ban đầu 10 lần thì thu được dung dịch trên
Câu 2 :
$[OH^-] = 10^{-14} : 10^{-9} = 10^{-5}M$
$n_{OH^-} = 10^{-5}.1 = 10^{-5}(mol)$
Sau khi pha :
$[OH^-] = 10^{-14} : 10^{-8} = 10^{-6}M$
$V_{dd} = \dfrac{10^{-5}}{10^{-6}} = 0,1(lít) = 100(ml)$
$V_{nước\ cần\ dùng} = 1000 - 100 = 900(ml)$
Phải pha loãng dung dịch HCl 0,1M bằng dung dung dịch HCl 0,005M ra sao để thu đượd dung dịch có pH =2
Dd co pH la 2 nen co nong do la 0,01 M
Ap dung quy tac duong cheo
0,1 0,005
0,01
0,005 0,09
Vay ta duoc 0,005/0,09=1/18
Hcl 0,1 1 phan va hcl 0,005 18 phan
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 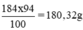
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 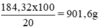
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.