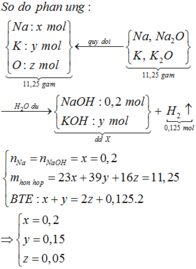Dẫn V lít CO2 (đktc) vào 200ml dung dịch NaOH 1M; Ca(OH)2 1M sau phản ứng thu được 10g chất rắn Tính V

Những câu hỏi liên quan
Sục V lít khí CO2 (đktc) vào 200ml dung dịch X gồm Ba(OH)2 1M và NaOH 1M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị lớn nhất của V là:
A. 13,44
B. 17,92
C. 20,16
D. 11,2
Đáp án D
Ta có:
nBa(OH)2= 0,2.1= 0,2 mol;
nNaOH= 0,2.1= 0,2 mol;
nBaCO3= 19,7/197= 0,1 mol
nOH-= 0,2.2 + 0,2= 0,6 mol; nBa2+= 0,2 mol
Do đề hỏi giá trị lớn nhất của V nên số mol CO2 phải lớn nhất. Khi đó xảy ra 2 PT sau:
CO2+ 2OH- → CO32-+ H2O (1)
0,1 0,2 ← 0,1 mol
CO2+ OH- → HCO3- (2)
0,4← (0,6-0,2)
Ba2++ CO32- → BaCO3 (3)
0,2 0,1 ← 0,1 mol
Theo PT (1), (2) ta có: nCO2= 0,1 + 0,4= 0,5 mol
→ VCO2= 0,5.22,4= 11,2 lít
Đúng 0
Bình luận (0)
Sục V lít khí CO2 (đktc) vào 200ml dung dịch gồm NaOH 0,75M và KOH 1M thu được dung dịch X chứa 4 muối. Cho từ từ đến hết dung dịch X vào 100 ml dung dịch chứa HCl 0,9M và H2SO4 0,95M thu được 4,48 lít CO2 (đktc) và dung dịch Y. Cho BaCl2 dư vào dung dịch Y thu được lượng kết tủa lớn hơn 24,0 gam. Giá trị của V là A. 6,72 lít B. 7,84 lít C. 5,60 lít D. 8,96 lít
Đọc tiếp
Sục V lít khí CO2 (đktc) vào 200ml dung dịch gồm NaOH 0,75M và KOH 1M thu được dung dịch X chứa 4 muối. Cho từ từ đến hết dung dịch X vào 100 ml dung dịch chứa HCl 0,9M và H2SO4 0,95M thu được 4,48 lít CO2 (đktc) và dung dịch Y. Cho BaCl2 dư vào dung dịch Y thu được lượng kết tủa lớn hơn 24,0 gam. Giá trị của V là
A. 6,72 lít
B. 7,84 lít
C. 5,60 lít
D. 8,96 lít
Hấp thụ V lít CO2 (đktc) vào 200ml dung dịch NaOH 1M thu được dung dịch X. Khi cho BaCl2 dư vào dung dịch X được kết tủa và dung dịch Y, đun nóng Y lại thấy có kết tủa xuất hiện. Khoảng giá trị của V là:
Đọc tiếp
Hấp thụ V lít CO2 (đktc) vào 200ml dung dịch NaOH 1M thu được dung dịch X. Khi cho BaCl2 dư vào dung dịch X được kết tủa và dung dịch Y, đun nóng Y lại thấy có kết tủa xuất hiện. Khoảng giá trị của V là:
![]()
![]()
![]()
![]()
Cho V lít khí CO2 (đktc) hấp thụ hoàn toàn vào 200ml dung dịch gồm có NaOH 1M và Ba(OH)2 0,5M thu được 15,76 gam kết tủa. Giá trị của V là A. 0,896. B. 1,792 hoặc 7,168. C. 1,792. D. 0,896 hoặc 3,584.
Đọc tiếp
Cho V lít khí CO2 (đktc) hấp thụ hoàn toàn vào 200ml dung dịch gồm có NaOH 1M và Ba(OH)2 0,5M thu được 15,76 gam kết tủa. Giá trị của V là
A. 0,896.
B. 1,792 hoặc 7,168.
C. 1,792.
D. 0,896 hoặc 3,584.
dẫn 6,72 lít khí co2 ở đktc vào 200ml dung dịch Ca(OH)2 1M. Tính khối lượng các muối sinh ra (giải bằng 2 cách)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PTHH :
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)(1)
0,2 0,2 0,2 0,2
\(CO_2+CaCO_3+H_2O\rightarrow Ca\left(HCO_3\right)_2\)(2)
0,1 0,1 0,1 0,1
Có :
\(\dfrac{n_{CO_2}}{n_{Ca\left(OH\right)_2}}=\dfrac{0,3}{0,2}\) => Tạo cả 2 muối: CaCO3 và Ca(HCO3)2
\(m_{CaCO_3}=\left(0,2-0,1\right).100=10\left(g\right)\)
\(m_{Ca\left(HCO_3\right)_2}=0,1.162=16,2\left(g\right)\)
Đúng 1
Bình luận (0)
Dưới đây là cách giải quyết từng bài tập của bạn:
Bài 5:
a) Tính thể tích khi Hydrogen (H2) sinh ra (ở đkc):
Theo phản ứng: 2Al + 3H2SO4 -> 3H2 + 2Al2(SO4)3
Khối lượng mol của Al = 5.4 g / 27 g/mol = 0.2 mol
Khối lượng mol của H2SO4 = 150 g / (2 g/mol + 32 g/mol + 4 g/mol) = 150 g / 98 g/mol ≈ 1.53 mol
Do phản ứng có tỷ số mol của Al và H2SO4 là 2:3, vậy Al sẽ là chất dư, và số mol H2 được sinh ra sẽ bằng 2/3 số mol H2SO4.
Số mol H2 = (2/3) * 1.53 mol ≈ 1.02 mol
Thể tích H2 ở điều kiện tiêu chuẩn (0°C và 1 atm) là 24.45 L/mol.
Vậy thể tích H2 sinh ra ≈ 1.02 mol * 24.45 L/mol ≈ 24.95 L.
b) Tính nồng độ phần trăm của dung dịch H2SO4:
Khối lượng H2SO4 ban đầu = 150 g
Nồng độ phần trăm của H2SO4 = (khối lượng H2SO4 / khối lượng dung dịch) * 100%
Nồng độ phần trăm của H2SO4 = (150 g / (150 g + 5.4 g)) * 100% ≈ 96.6%
c) Tính khối lượng muối tạo thành:
Theo phản ứng: 2Al + 3H2SO4 -> 3H2 + 2Al2(SO4)3
Khối lượng mol của Al2(SO4)3 = 0.2 mol
Khối lượng muối tạo thành = (0.2 mol * 2 * (98 g/mol)) / 2 = 19.6 g.
Bài 8:
a) Tính m:
Theo phản ứng: 2Al + 6HCl -> 2AlCl3 + 3H2
Số mol H2 = 7.437 L / 22.4 L/mol = 0.332 mol
Số mol Al = 0.5 * số mol H2 = 0.5 * 0.332 mol = 0.166 mol
Khối lượng Al = 0.166 mol * 27 g/mol = 4.482 g
b) Tính nồng độ mol dung dịch HCl cần dùng:
Số mol HCl cần dùng = số mol Al = 0.166 mol
Thể tích dung dịch HCl = 300 ml = 0.3 L
Nồng độ mol của HCl = (0.166 mol / 0.3 L) ≈ 0.553 mol/L
c) Tính nồng độ mol dung dịch muối thu được:
Theo phản ứng: 2Al + 6HCl -> 2AlCl3 + 3H2
Số mol AlCl3 = 0.166 mol
Khối lượng mol của AlCl3 = 0.166 mol * (133.5 g/mol) = 22.121 g
Nồng độ mol của AlCl3 = (0.166 mol / 0.3 L) ≈ 0.553 mol/L
Lưu ý rằng phần c của câu 8 cho biết thể tích dung dịch không đáng kể thay đổi, vì vậy nồng độ mol của muối AlCl3 sau phản ứng là tương tự nồng độ mol của dung dịch HCl ban đầu.
Đúng 0
Bình luận (0)
Sục V lít CO2 vào 200ml dung dịch gồm Ca(OH)2 xM và NaOH 1M thu được 10g kết tủa và dung dịch A. Sục thêm V lít CO2 vào dung dịch A thu được 5g kết tủa. Giá trị của V và x là ?
Dẫn 3,36 lít khí CO2 qua 200ml dụng dịch NaOH 1M. Tính nồng độ mol dung dịch thu được.
Ta có: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,2}{0,15}=\dfrac{4}{3}\)
→ Pư tạo NaHCO3 và Na2CO3
PT: \(CO_2+NaOH\rightarrow NaHCO_3\)
\(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Theo PT: \(\left\{{}\begin{matrix}n_{CO_2}=n_{NaHCO_3}+n_{Na_2CO_3}=0,15\\n_{NaOH}=n_{NaHCO_3}+2n_{Na_2CO_3}=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHCO_3}=0,1\left(mol\right)\\n_{Na_2CO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaHCO_3}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{Na_2CO_3}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Dẫn từ từ 4,48 lít khí CO2 (đktc) vào 500ml dung dịch NaOH 1M thu được dung dịch Y. Thành phần chất tan trong dung dịch Y là:
A. NaOH, Na2CO3
B. Na2CO3
C. NaOH, NaHCO3
D. NaHCO3, Na2CO3
Đáp án A
Ta có: nCO2= 4,48/22,4= 0,2 mol; nNaOH= 0,5.1= 0,5 mol
→ Sau phản ứng thu được Na2CO3 và NaOH còn dư
2NaOH + CO2 → Na2CO3 + H2O
Đúng 0
Bình luận (0)
Hòa tan 11,25 gam hỗn hợp Na, K, Na2O, K2O vào nước dư, thu được 2,8 lít khí và dung dịch X trong đó có chứa 8 gam NaOH. Dẫn V lít CO2 vào dung dịch X được dung dịch Y. Cho từ từ dung dịch Y vào 280 ml dung dịch HCl 1M thấy thoát ra 4,48 lít khí CO2. Các chất khí đều đo ở đktc. Giá trị của V là A. 6,272 B. 4,480 C. 6,720 D. 5,600
Đọc tiếp
Hòa tan 11,25 gam hỗn hợp Na, K, Na2O, K2O vào nước dư, thu được 2,8 lít khí và dung dịch X trong đó có chứa 8 gam NaOH. Dẫn V lít CO2 vào dung dịch X được dung dịch Y. Cho từ từ dung dịch Y vào 280 ml dung dịch HCl 1M thấy thoát ra 4,48 lít khí CO2. Các chất khí đều đo ở đktc. Giá trị của V là
A. 6,272
B. 4,480
C. 6,720
D. 5,600
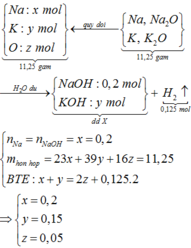
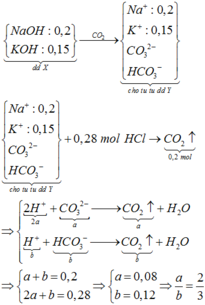
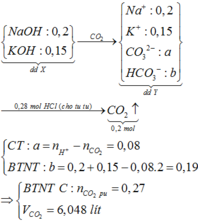
Hòa tan 11,25 gam hỗn hợp Na, K, Na2O, K2O vào nước dư, thu được 2,8 lít khí và dung dịch X trong đó có chứa 8 gam NaOH. Dẫn V lít CO2 vào dung dịch X được dung dịch Y. Cho từ từ 280 ml dung dịch HCl 1M vào dung dịch Y thấy thoát ra 4,48 lít khí CO2. Các chất khí đều đo ở đktc. Giá trị của V là A. 6,048 B. 4,480 C. 6,720 D. 5,600
Đọc tiếp
Hòa tan 11,25 gam hỗn hợp Na, K, Na2O, K2O vào nước dư, thu được 2,8 lít khí và dung dịch X trong đó có chứa 8 gam NaOH. Dẫn V lít CO2 vào dung dịch X được dung dịch Y. Cho từ từ 280 ml dung dịch HCl 1M vào dung dịch Y thấy thoát ra 4,48 lít khí CO2. Các chất khí đều đo ở đktc. Giá trị của V là
A. 6,048
B. 4,480
C. 6,720
D. 5,600