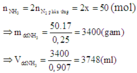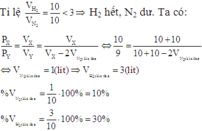cho 5 lít N2 và 15 lít H2 vào một bình kín dung tích không đổi .ở 00C ,áp suất trong bình là P1 atm .đun nóng bình một thời gian thì thấy có 20% N2 tham gia phản ứng , đưa bình về nhiệt độ ban đầu thấy áp suất trong bình lúc này là P2.tỉ lệ P1 và P2 là

Những câu hỏi liên quan
Cho 5 lít N2 và 15 lít H2 vào một bình kín dung tích không đổi . Ở 00C, áp suất trong bình là P1 atm. Đun nóng bình một thời gian thấy có 20% N2 tham gia phản ứng, đưa bình về nhiệt độ ban đầu thấy áp suất trong bình lúc này là P2 atm. Tỉ lệ P1 và P2 là: A. 6 : 10 B. 10 : 6 C. 10 : 9 D. 9 : 10
Đọc tiếp
Cho 5 lít N2 và 15 lít H2 vào một bình kín dung tích không đổi . Ở 00C, áp suất trong bình là P1 atm. Đun nóng bình một thời gian thấy có 20% N2 tham gia phản ứng, đưa bình về nhiệt độ ban đầu thấy áp suất trong bình lúc này là P2 atm. Tỉ lệ P1 và P2 là:
A. 6 : 10
B. 10 : 6
C. 10 : 9
D. 9 : 10
Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất

Đúng 0
Bình luận (0)
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu. Tính hiệu suất của phản ứng điều chế NH3? A. 25% B. 20% C. 75% D. 45%
Đọc tiếp
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu.
Tính hiệu suất của phản ứng điều chế NH3?
A. 25%
B. 20%
C. 75%
D. 45%
Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2
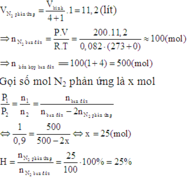
Đúng 0
Bình luận (0)
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu. Lấy toàn bộ lượng NH3 trên thì có thể điều chế được bao nhiêu lít dd NH3 nồng độ 25% (d 0,907 g/ml) A. 0,1376 lít B. 2,838 lít C. 3,784 lít D. 3,4056 lít
Đọc tiếp
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu.
Lấy toàn bộ lượng NH3 trên thì có thể điều chế được bao nhiêu lít dd NH3 nồng độ 25% (d = 0,907 g/ml)
A. 0,1376 lít
B. 2,838 lít
C. 3,784 lít
D. 3,4056 lít
Trong một bình kín chứa 10 lít N2 và 10 lít H2 ở nhiệt độ 00C, 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 00C. Nếu áp suất trong bình sau phản ứng là 9 atm thì phần tram các khí tham gia phản ứng là A. N2: 20%; H2:40% B. N2: 30%; H2:20% C. N2: 10%; H2:30% D. N2: 20%; H2:20%
Đọc tiếp
Trong một bình kín chứa 10 lít N2 và 10 lít H2 ở nhiệt độ 00C, 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 00C. Nếu áp suất trong bình sau phản ứng là 9 atm thì phần tram các khí tham gia phản ứng là
A. N2: 20%; H2:40%
B. N2: 30%; H2:20%
C. N2: 10%; H2:30%
D. N2: 20%; H2:20%
Trong một bình kín dung tích 56 lít chứa đầy N2 và H2 theo tỉ lệ thể tích 1:4 ở 00C và 200atm, có một ít bột xúc tác Ni. Nung nóng bình một thời gian, sau đó đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu. Hiệu suất của phản ứng là: A. 18,75% B. 20% C. 30% D. 25%
Đọc tiếp
Trong một bình kín dung tích 56 lít chứa đầy N2 và H2 theo tỉ lệ thể tích 1:4 ở 00C và 200atm, có một ít bột xúc tác Ni. Nung nóng bình một thời gian, sau đó đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu. Hiệu suất của phản ứng là:
A. 18,75%
B. 20%
C. 30%
D. 25%
Đáp án D.
Ban đầu: nhỗn hợp= PV/RT= 56.200/0,082.273= 500 mol
→nN2=100 mol, nH2= 400 mol

Sau khi phản ứng xảy ra đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu
→Số mol khí cũng giảm 10%
→nkhí sau pứ= 500- 10%.500= 450 mol
Mà nkhí sau pứ= (100-x)+ (400-3x)+2x= 450
→x=25 mol
→H= (x/100).100%=25%
Đúng 0
Bình luận (0)
Trong bình kín thể tích không đổi 56lít chứa N2, H2 theo tỉ lệ thể tích 1 : 4 ở nhiệt độ 00C, áp suất 200atm và ít xúc tác (thể tích xúc tác không đáng kể). Nung nóng bình một thời gian sau đưa về 00C thấy áp suất giảm 5% so với ban đầu. Tính hiệu suất phản ứng tổng hợp amoniac là A. 20% B. 12,5% C. 15% D. 10%
Đọc tiếp
Trong bình kín thể tích không đổi 56lít chứa N2, H2 theo tỉ lệ thể tích 1 : 4 ở nhiệt độ 00C, áp suất 200atm và ít xúc tác (thể tích xúc tác không đáng kể). Nung nóng bình một thời gian sau đưa về 00C thấy áp suất giảm 5% so với ban đầu. Tính hiệu suất phản ứng tổng hợp amoniac là
A. 20%
B. 12,5%
C. 15%
D. 10%
Chọn B. nhh= 500 mol → nN2= 100 mol ; nH2= 400 mol.
N2 + 3H2 → 2NH3
| Mol đầu |
100 |
400 |
0 |
| Mol pứ |
x |
3x |
0 |
| Mol cb |
100-x |
400-3x |
2x |
n hh sau = (400-2x) mol
Đề cho
n1.P2=n2.P1 bới P2=0,95P1
0,95.400= 400-2x
x= 12,5 mol.
Tính hiệu suất theo N2 → H%= 12,5 % (Tính hiệu suất theo chất nào mà kết quả ra cao hơn)
Đúng 0
Bình luận (0)
Trong một bình kín dung tích không đổi ở đktc chứa etilen và H2, có bột Ni xúc tác. Đun nóng bình một thời gian sau đó đưa bình về nhiệt độ ban đầu (0oC), áp suất bình là p (atm). Cho biết tỉ khối hơi của hỗn hợp đầu và hỗn hợp sau phản ứng so với hiđro lần lượt là 7,5 và 9. Tính % thể tích của C2H6 có trong hỗn hợp sau phản ứng ? A. 20% B. 40% C. 60% D. 80%
Đọc tiếp
Trong một bình kín dung tích không đổi ở đktc chứa etilen và H2, có bột Ni xúc tác. Đun nóng bình một thời gian sau đó đưa bình về nhiệt độ ban đầu (0oC), áp suất bình là p (atm). Cho biết tỉ khối hơi của hỗn hợp đầu và hỗn hợp sau phản ứng so với hiđro lần lượt là 7,5 và 9. Tính % thể tích của C2H6 có trong hỗn hợp sau phản ứng ?
A. 20%
B. 40%
C. 60%
D. 80%
Đáp án A
Đặt nC2H4 ban đầu = x mol; nH2 = y mol.
Ta có MY = 18 → H2 dư; hhY gồm C2H6 và H2 dư.
Theo BTKL: mX = mY = 28x + 2y gam.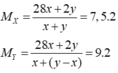
→ y = 5x → hhY gồm x mol C2H6 và 4x mol H2.
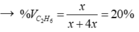
Đúng 0
Bình luận (0)
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là A. 1,35 atm B. 1,75 atm C. 2 atm D. 2,5 atm
Đọc tiếp
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là
A. 1,35 atm
B. 1,75 atm
C. 2 atm
D. 2,5 atm
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là: A. 1,35 atm. B. 1,75 atm. C. 2 atm. D. 2,5 atm.
Đọc tiếp
Cho vào một bình kín dung tích không đổi a mol Cl2 và 1 mol H2 thì áp suất của bình là 2,5 atm. Nung nóng bình cho phản ứng xảy ra với hiệu suất đạt 80%. Đưa bình về nhiệt độ ban đầu thì áp suất của bình là:
A. 1,35 atm.
B. 1,75 atm.
C. 2 atm.
D. 2,5 atm.
Chọn đáp án D.
+ Áp suất tỷ lệ với số mol p 1 p 2 = n 1 n 2
+ Ta dễ thấy dù phản ứng xảy ra với hiệu suất bao nhiêu thì số mol khí cũng không đổi → p = c o n s t = 2 , 5 a t m
Đúng 0
Bình luận (0)
cho 50l hỗn hợp khí X gồm N2 và H2 vào bình kín ( không có không khí ) . Tiến hành tổng hợp khí Amoniac ở điều khiện thích hợp : N2 + H2 -- NH3 . Sau một thời gian phản ứng đưa về điều kiện nhiệt độ , áp suất ban đầu thì thu được 44 lít hỗn hợp khí Y có 25% thể tích khí N2 . Thêm vào Y 6 lít N2O ở cùng điều kiện được hỗn hợp Z a) Tính thành phần % theo thể tích từng khí trong Xb) Tính khối lượng của 11,2 lít hỗn hợp Z ở đktc
Đọc tiếp
cho 50l hỗn hợp khí X gồm N2 và H2 vào bình kín ( không có không khí ) . Tiến hành tổng hợp khí Amoniac ở điều khiện thích hợp : N2 + H2 --> NH3 . Sau một thời gian phản ứng đưa về điều kiện nhiệt độ , áp suất ban đầu thì thu được 44 lít hỗn hợp khí Y có 25% thể tích khí N2 . Thêm vào Y 6 lít N2O ở cùng điều kiện được hỗn hợp Z
a) Tính thành phần % theo thể tích từng khí trong X
b) Tính khối lượng của 11,2 lít hỗn hợp Z ở đktc
a) Giả sử các khí đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol N2, H2 ban đầu là a, b (mol)
=> a + b = 50 (1)
Gọi số mol N2 pư là x (mol)
PTHH: N2 + 3H2 --to,xt--> 2NH3
Trc pư: a b 0
Pư: x---->3x----------->2x
Sau pư (a-x) (b-3x) 2x
=> a + b - 2x = 44
=> x = 3 (mol)
Có \(n_{N_2\left(sau.pư\right)}=a-x=44.25\%=11\left(mol\right)\)
=> a = 14 (mol)
=> b = 36 (mol)
\(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{14}{50}.100\%=28\%\\\%V_{H_2}=\dfrac{36}{50}.100\%=72\%\end{matrix}\right.\)
Y chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\end{matrix}\right.\)
Z chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\\N_2O:6\left(mol\right)\end{matrix}\right.\)
\(Z\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{11}{11+27+6+6}.100\%=22\%\\\%V_{H_2}=\dfrac{27}{11+27+6+6}.100\%=54\%\\\%V_{NH_3}=\dfrac{6}{11+27+6+6}.100\%=12\%\\\%V_{N_2O}=\dfrac{6}{11+27+6+6}.100\%=12\%\end{matrix}\right.\)
b)
11,2 lít hh Z ở đktc chứa \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{11,2.22\%}{22,4}=0,11\left(mol\right)\\n_{H_2}=\dfrac{11,2.54\%}{22,4}=0,27\left(mol\right)\\n_{NH_3}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\\n_{N_2O}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\end{matrix}\right.\)
=> mZ = 0,11.28 + 0,27.2 + 0,06.17 + 0,06.44 = 7,28 (g)
Đúng 1
Bình luận (0)