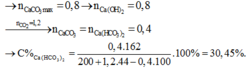B2: Cho 8,8gam CO2 vào 400ml dd Ca(OH)2 1M.Muối tạo thành sau phản ứng là gì?

Những câu hỏi liên quan
Cho 0,308g CO2 từ từ vào 2 lít dd Ca(OH)2 0,002M,phản ứng xong cho tiếp 5g dd NaOH 4% vào. Tính khối lượng các muối tạo thành?
Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{0,308}{44}=0,007\left(mol\right)\\n_{Ca\left(OH\right)_2}=2\cdot0,002=0,004\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\)
2a______a____________a (mol)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
b_______b_________b (mol)
Ta lập được HPT: \(\left\{{}\begin{matrix}2a+b=0,007\\a+b=0,002\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=n_{Ca\left(HCO_3\right)_2}=0,003\left(mol\right)\\b=n_{CaCO_3}=0,001\left(mol\right)\end{matrix}\right.\)
PTHH: \(Ca\left(HCO_3\right)_2+2NaOH\rightarrow CaCO_3\downarrow+Na_2CO_3+2H_2O\)
Ta có: \(n_{NaOH}=\dfrac{5\cdot4\%}{40}=0,005\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,003}{1}>\dfrac{0,005}{2}\) \(\Rightarrow\) Ca(HCO3)2 còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{Na_2CO_3}=0,0025\left(mol\right)\\n_{Ca\left(HCO_3\right)_2\left(dư\right)}=0,0005\left(mol\right)\\\Sigma n_{CaCO_3}=0,001+0,0025=0,0035\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Na_2CO_3}=0,0025\cdot106=0,265\left(g\right)\\m_{Ca\left(HCO_3\right)_2}=0,0005\cdot162=0,081\left(g\right)\\m_{CaCO_3}=0,0035\cdot100=0,35\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Câu 19. Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?-A. Cho dd Ca(OH)2 phản ứng với SO2.-B. Cho dd NaOH phản ứng với dd H2SO4.-C. Cho dd Cu(OH)2 phản ứng với HCl.-D. Nung nóng Cu(OH)2.Câu 20: Dãy chất gồm các oxit axit là: A. CO2, SO2, NO, P2O5.B. CO2, SO3, Na2O, NO2.C. SO2, P2O5, CO2, SO3.D. H2O, CO, NO, Al2O3.Câu 21: Dãy chất gồm các oxit bazơ: A. CuO, NO, MgO, CaO.B. CuO, CaO, MgO, Na2O.C. CaO, CO2, K2O, Na2O.D. K2O, FeO, P2O5, Mn2O7.Câu 22: Dãy chất sau là oxit lưỡng tính:A. Al2O3, ZnO,...
Đọc tiếp
Câu 19. Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?
-A. Cho dd Ca(OH)2 phản ứng với SO2.
-B. Cho dd NaOH phản ứng với dd H2SO4.
-C. Cho dd Cu(OH)2 phản ứng với HCl.
-D. Nung nóng Cu(OH)2.
Câu 20: Dãy chất gồm các oxit axit là:
A. CO2, SO2, NO, P2O5.
B. CO2, SO3, Na2O, NO2.
C. SO2, P2O5, CO2, SO3.
D. H2O, CO, NO, Al2O3.
Câu 21: Dãy chất gồm các oxit bazơ:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
Câu 22: Dãy chất sau là oxit lưỡng tính:
A. Al2O3, ZnO, PbO2, Cr2O3.
B. Al2O3, MgO, PbO, SnO2.
C. CaO, ZnO, Na2O, Cr2O3.
D. PbO2, Al2O3, K2O, SnO2.
Câu 23:Dãy oxit tác dụng với nước tạo ra dung dịch kiềm:
A. CuO, CaO, K2O, Na2O.
B. CaO, Na2O, K2O, BaO.
C. Na2O, BaO, CuO, MnO.
D. MgO, Fe2O3, ZnO, PbO.
Câu 24. Để điều chế Cu(OH)2 người ta cho:
A. CuO tác dụng với dung dịch HCl.
B. CuCl2 tác dụng với dung dịch NaOH.
C. CuSO4 tác dụng với dung dịch BaCl2.
D. CuCl2 tác dụng với dung dịch AgNO3.
Câu 25. Để điều chế dung dịch Ba(OH)2, người ta cho:
A. BaO tác dụng với dung dịch HCl.
B. BaCl2 tác dụng với dung dịch Na2CO3.
C. BaO tác dụng với dung dịch H2O.
D. Ba(NO3)2 tác dụng với d.dịch Na2SO4.
Câu 26. Để điều chế dung dịch KOH, người ta cho:
A. K2CO3 tác dụng với dung dịch Ca(OH)2.
B. K2SO4 tác dụng với dung dịch NaOH.
C. K2SO3 tác dụng với dung dịch CaCl2.
D. K2CO3 tác dụng với dung dịch NaNO3.
Câu 27: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142đvC. Công thức hoá học của oxit là:
A. P2O3.
B. P2O5.
C. PO2.
D. P2O4.
Câu 28: Một oxit được tạo bởi 2 nguyên tố là sắt và oxi, trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Công thức hoá học của oxit sắt là:
A. FeO.
B. Fe2O3.
C. Fe3O4.
D. FeO2.
Câu29: Có thể tinh chế CO ra khỏi hỗn hợp (CO + CO2) bằng cách
:
A. Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư. B. Dẫn hỗn hợp qua dung dịch PbCl2 dư.
C. Dẫn hỗn hợp qua NH3. D. Dẫn hỗn hợp qua dung dịch Cu(NO3)2.
Câu 30: Cho a g Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Vậy a có giá trị:
A. 15,9 g.
B. 10,5 g.
C. 34,8 g.
D. 18,2 g.
Câu 31. Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi.
B.Màu xanh nhạt dần rồi mất hẳn.
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ.
D. Màu xanh đậm thêm dần.
Câu 32. Nhóm các khí đều không phản ứng với dung dịch KOH ở điều kiện thường:
A. CO2, N2O5, H2S.
B. CO2, SO2, SO3.
C. NO2, HCl, HBr
D. CO, NO, N2O.
Câu 33. Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá san. B. Làm quỳ tím hoá đỏ.
C. Phản ứng được với magiê giải phóng khí hidrô. D. Không làm đổi màu quỳ tím.
Câu 34. Cho 1g NaOH rắn tác dụng với dung dịch chứa 1g HNO3. Dung dịch sau phản ứng có môi trường:
A. Trung tính \\\ B. Bazơ \\\ C. Axít \\ D. Lưỡng tính
Câu 35: Cho các oxit : Na2O , CO , CaO , P2O5 , SO2. Có bao nhiêu cặp chất tác dụng được với nhau ?
A. 2.
B. 3.
C. 4.
D. 5.
***** VẬN DỤNG *****
Câu 36: Khử hoàn toàn 0,58 tấn quặng sắt chứa 90 % là Fe3O4 bằng khí hiđro. Khối lượng sắt thu được là:
A. 0,378 tấn.
\\ B. 0,156 tấn. \\
C. 0,126 tấn. \\
D. 0,467 tấn.
Câu 37: Thể tích khí hiđro (đktc) cần dùng để khử hoàn toàn hỗn hợp gồm 20 g CuO và 111,5g PbO là:
A. 11,2 lít.
B. 16,8 lít.
C. 5,6 lít.
D. 8,4 lí
Đốt cháy hoàn toàn 11,2 lít khí etilen. a) tính thể tích không khí cần dùng ( biết Vo2 = 1/5 vkk ) b) tính khối lượng các chất tạo thành c) dẫn toàn bộ lượng khí Co2 sinh ra ở phản ứng trên vào dd Ca(OH)2 10%. Tính khối lượng dd Ca(OH)2 cần dùng.
\(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\\ a,n_{O_2}=3.0,5=1,5\left(mol\right)\\ V_{O_2\left(đktc\right)}=1,5.22,4=33,6\left(l\right)\\ V_{kk\left(đktc\right)}=33,6.5=168\left(l\right)\\ b,n_{CO_2}=n_{H_2O}=2.0,5=1\left(mol\right)\\ m_{CO_2}=44.1=44\left(g\right);m_{H_2O}=18.1=18\left(g\right)\\ c,CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\\ n_{Ca\left(OH\right)_2}=n_{CO_2}=1\left(mol\right)\\ m_{Ca\left(OH\right)_2}=1.74=74\left(g\right)\\ m_{ddCa\left(OH\right)_2}=\dfrac{74.100}{10}=740\left(g\right)\)
Đúng 1
Bình luận (0)
Thực hiện các thí nghiệm sau: (a) Đun sôi nước cứng tạm thời. (b) Cho phèn chua vào lượng dư dd Ba(OH)2. (c) Cho dd NH3 dư vào dd AlCl3 (d) Sục khí CO2 đến dư vào dd Ca(OH)2. (e) Cho dd HCl dư vào dd NaAlO2. Sau khi kết thúc phản ứng, số thí nghiệm thu được kết tủa là A. 5 B. 4 C. 2 D. 3
Đọc tiếp
Thực hiện các thí nghiệm sau:
(a) Đun sôi nước cứng tạm thời.
(b) Cho phèn chua vào lượng dư dd Ba(OH)2.
(c) Cho dd NH3 dư vào dd AlCl3
(d) Sục khí CO2 đến dư vào dd Ca(OH)2.
(e) Cho dd HCl dư vào dd NaAlO2.
Sau khi kết thúc phản ứng, số thí nghiệm thu được kết tủa là
A. 5
B. 4
C. 2
D. 3
Đáp án D
(a) Đun sôi nước cứng tạm thời.
(b) Cho phèn chua vào lượng dư dd Ba(OH)2.
(c) Cho dd NH3 dư vào dd AlCl3.
Đúng 0
Bình luận (0)
Dẫn 1,12 lít khí lưu huỳnh dioxit ( đktc) vào 700ml dd Ca(OH)2 0,1M a. Cho biết muối nào tạo thành b. Tính khối lượng các chất sau phản ứng
Số mol của lưu huỳnh đioxit ở dktc
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
700ml = 0,7l
Số mol của dung dịch canxi hidroxi CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_m.V=0,1.0,7=0,07\left(mol\right)\)
Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,07 0,05
a) Tên muối tạo thành là : canxi sunfit
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,07}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của SO2
Số mol của muối canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,07 - (0,05 . 1)
= 0,02 (mol)
Khối lượng dư của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,02 . 74
= 1,48 (g)
Chúc bạn học tốt
Đúng 3
Bình luận (0)
Thực hiện các thí nghiệm sau: a) Cho dd Ba(HCO3)2 vào dd KHSO4 b) Cho K vào dd CuSO4 dư c) Cho dd NH4NO3 vào dd Ba(OH)2 d) Cho dd HCl tới dư vào dd C6H5ONa e) Cho dd CO2 tới dư vào dd gồm NaOH và Ca(OH)2 Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn lẫn chất khí là A.2 B.4 C.3 D.5
Thực hiện các thí nghiệm sau:
a) Cho dd Ba(HCO3)2 vào dd KHSO4
b) Cho K vào dd CuSO4 dư
c) Cho dd NH4NO3 vào dd Ba(OH)2
d) Cho dd HCl tới dư vào dd C6H5ONa
e) Cho dd CO2 tới dư vào dd gồm NaOH và Ca(OH)2
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn lẫn chất khí là
A.2 B.4 C.3 D.5
Đúng 2
Bình luận (1)
2 ví dụ cuối
d) \(HCl+C_6H_5ONa\rightarrow NaCl+C_6H_5OH\)
e) \(CO_2+NaOH\rightarrow NaHCO_3\)
\(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\)
Các p/ứ trên không tạo khí
Đúng 1
Bình luận (0)
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau: Nồng độ % chất tan trong dung dịch sau phản ứng là A. 30,45% B. 32,4% C. 25,63% D. 40,5%
Đọc tiếp
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau:

Nồng độ % chất tan trong dung dịch sau phản ứng là
A. 30,45%
B. 32,4%
C. 25,63%
D. 40,5%
Đáp án A
PTHH : (1) CO2 + Ca(OH)2 → CaCO3 + H2O
(2) CaCO3 + CO2 + H2O → Ca(HCO3)2
Theo đồ thị :
+) Khi n C O 2 = 0,8 mol → n k t m a x = n C a ( O H ) 2 = 0,8 mol
+) Khi n C O 2 = 1,2 mol → n C a C O 3 b ị h ò a tan = = 1,2 – 0,8 = 0,4 mol
→ n C a C O 3 c h ư a b ị h ò a tan = 0,8 – 0,4 = 0,4 mol
Ta có: khối lượng dung dịch sau phản ứng = m C O 2 p . ư + m d d C a ( O H ) 2 – m C a C O 3
= 1,2.44 + 200 – 0,4.100 = 212,8 gam → % C C a H C O 3 = 30,45%
Đúng 0
Bình luận (0)
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau: Nồng độ % chất tan trong dung dịch sau phản ứng là A. 30,45% B. 32,4% C. 25,63% D. 40,5%
Đọc tiếp
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau: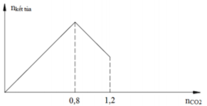
Nồng độ % chất tan trong dung dịch sau phản ứng là
A. 30,45%
B. 32,4%
C. 25,63%
D. 40,5%
PTHH : (1) CO2 + Ca(OH)2 → CaCO3 + H2O
(2) CaCO3 + CO2 + H2O → Ca(HCO3)2
Theo đồ thị :
+) Khi n(CO2) = 0,8 mol → n(kết tủa max) = n(Ca(OH)2) = 0,8 mol
+) Khi n(CO2) = 1,2 mol → n(CaCO3 bị hòa tan) = n(Ca(HCO3)2) = 1,2 – 0,8 = 0,4 mol
→ n(CaCO3 chưa bị hòa tan) = 0,8 – 0,4 = 0,4 mol
Ta có : khối lượng dung dịch sau phản ứng = m(CO2 phản ứng) + m(dung dịch Ca(OH)2) – m(CaCO3)
= 1,2*44 + 200 – 0,4*100 = 212,8 gam
→ C%(Ca(HCO3)2) = 30,45% → Đáp án A
Đúng 0
Bình luận (0)
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau: Nồng độ % chất tan trong dung dịch sau phản ứng là: A. 30,45%. B. 32,40%. C. 25,63%. D. 40,50%.
Đọc tiếp
Sục CO2 vào 200 gam dung dịch Ca(OH)2. Mối quan hệ giữa số mol CO2 và số mol kết tủa tạo thành được biểu diễn trên đồ thị sau:
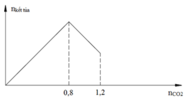
Nồng độ % chất tan trong dung dịch sau phản ứng là:
A. 30,45%.
B. 32,40%.
C. 25,63%.
D. 40,50%.