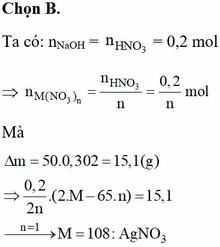Ngâm 1 lá Zn có khối lượng 1g trong V (ml) dd Cu(NO3)2 2M. PƯ xong khối lượng lá Zn giảm 10% so với ban đầu. Tính giá trị của V.

Những câu hỏi liên quan
Nhúng một lá Zn vào 200 ml dung dịch CuSO4 nồng độ x (mol/l) đến khi dung dịch mất màu hoàn toàn thấy khối lượng lá Zn giảm 0,15 gam so với ban đầu (coi kim loại tạo thành bán hết vào lá kẽm). Giá trị của x là: A. 0,75 B. 0,25 C. 0,35 D. 0,30
Đọc tiếp
Nhúng một lá Zn vào 200 ml dung dịch CuSO4 nồng độ x (mol/l) đến khi dung dịch mất màu hoàn toàn thấy khối lượng lá Zn giảm 0,15 gam so với ban đầu (coi kim loại tạo thành bán hết vào lá kẽm). Giá trị của x là:
A. 0,75
B. 0,25
C. 0,35
D. 0,30
Đáp án A
Zn + CuSO4 → ZnSO4 + Cu
Đặt nZn pứ = a mol → nCu = a mol
Sau khi dung dịch CuSO4 mất màu hoàn toàn thì CuSO4 phản ứng hết.
→ Khối lượng lá Zn giảm là mchất rắn giảm = mZn pứ - mCu sinh ra = 65a - 64a = a = 0,15
→ x = CM CuSO4 = n/Vdd = 0,15: 0,2 = 0,75M
Đúng 0
Bình luận (0)
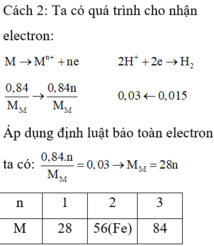
Ngâm một lá Zn trong 100ml dung dịch AgNO3 0,1M, sau đó lấy thanh Zn ra rồi cho tiếp dung dịch HCl vào dung dịch vừa thu được thì không thấy hiện tượng gì. Hỏi khối lượng lá Zn tăng hay giảm bao nhiêu gam so với ban đầu: A. Tăng 0,755g. B. Giảm 0,567g. C. Tăng 2,16g. D. Tăng 1,08g.
Đọc tiếp
Ngâm một lá Zn trong 100ml dung dịch AgNO3 0,1M, sau đó lấy thanh Zn ra rồi cho tiếp dung dịch HCl vào dung dịch vừa thu được thì không thấy hiện tượng gì. Hỏi khối lượng lá Zn tăng hay giảm bao nhiêu gam so với ban đầu:
A. Tăng 0,755g.
B. Giảm 0,567g.
C. Tăng 2,16g.
D. Tăng 1,08g.
Đáp án A
Vì khi cho HCl vào dung dịch vừa thu được không thấy hiện tượng gì nên trong dung dịch không còn Ag+
![]()
Do đó Ag+ đã phản ứng hết với Zn.
Đúng 0
Bình luận (0)
Ngâm 1 lá Cu có khối lượng 10g trong 250g đe AgNO3 4%. Khi pư kết thúc lấy lá Cu ra thấy khối lượng giảm 17%. Xđ khối luongj Cu sau pư
pthh bạn tự viết nha
khối lượng dung dịch giảm chính là khối lượng kim loại tăng (định luật bảo toàn khối lượng )
=>khối lượng kim loại sau phản ứng là : 10 + 1. 7= 11. 7 g
Đúng 0
Bình luận (0)
Điện phân 200 ml dung dịch M(NO3)n bằng điện cực trơ đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hoà dung dịch sau điện phân, phải dùng 250 ml dung dịch NaOH 0,8M. Mặt khác, nếu ngâm một thanh Zn có khối lượng 50 gam vào 200 ml dung dịch M(NO3)n khi phản ứng xong thấy khối lượng thanh Zn tăng thêm 30,2% so với ban đầu. Công thức của M(NO3)n là A. Pb(NO3)2 B. AgNO3 C. Cd(NO3)2 D. KNO3
Đọc tiếp
Điện phân 200 ml dung dịch M(NO3)n bằng điện cực trơ đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hoà dung dịch sau điện phân, phải dùng 250 ml dung dịch NaOH 0,8M. Mặt khác, nếu ngâm một thanh Zn có khối lượng 50 gam vào 200 ml dung dịch M(NO3)n khi phản ứng xong thấy khối lượng thanh Zn tăng thêm 30,2% so với ban đầu. Công thức của M(NO3)n là
A. Pb(NO3)2
B. AgNO3
C. Cd(NO3)2
D. KNO3
Điện phân 200 ml dung dịch M(NO3)n bằng điện cực trơ đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hoà dung dịch sau điện phân, phải dùng 250 ml dung dịch NaOH 0,8M. Mặt khác, nếu ngâm một thanh Zn có khối lượng 50 gam vào 200 ml dung dịch M(NO3)n khi phản ứng xong thấy khối lượng thanh Zn tăng thêm 30,2% so với ban đầu. Công thức của M(NO3)n là A. Pb(NO3)2 B. AgNO3 C. Cd(NO3)2 D. KNO3
Đọc tiếp
Điện phân 200 ml dung dịch M(NO3)n bằng điện cực trơ đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hoà dung dịch sau điện phân, phải dùng 250 ml dung dịch NaOH 0,8M. Mặt khác, nếu ngâm một thanh Zn có khối lượng 50 gam vào 200 ml dung dịch M(NO3)n khi phản ứng xong thấy khối lượng thanh Zn tăng thêm 30,2% so với ban đầu. Công thức của M(NO3)n là
A. Pb(NO3)2
B. AgNO3
C. Cd(NO3)2
D. KNO3
Ngâm 1 lá kẽm trong 500ml dung dịch pb(no3)2 nồng độ 2M. Sau 1 thời gian lấy lá kẽm ra rửa cẩn thận làm khô, cân lại thì thấy nặng hơn so vs ban đầu 1,42g.
a) Hãy tính khối lượng chì bám vào lá kẽm.
b) nồng độ mol của dd sau khi lấy lá kẽm ra.
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
Đúng 0
Bình luận (0)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình
Đúng 0
Bình luận (0)
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336 ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68% so với ban đầu. Kim loại đó là
A. Zn.
B. Fe.
C. Ni.
D. Al
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336 ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68% so với ban đầu. Kim loại đó là A.
A. Zn.
B. Fe.
C. Ni.
D. Al.
Hòa tan hoàn toàn 4,55g kim loại Zn vào 200 mL dd HCl (khối lượng riêng là 0,8 g/ml), sau PƯ thu đc V lít khí (đktc) và dd X
a) Tính nồng độ mol dd HCl tham gia PƯ
b) Tính giá trị V
c) Cô cạn dd X hoàn toàn, tính khối lượng chất rắn còn lại
d) Cho dd X PƯ đủ với 200g dd AgNO3, thu đc ddY. Tính nồng độ % dd Y
(Cho Zn=65, Cl=35.5, H=1)
\(n_{Zn}=\dfrac{4,55}{65}=0,07(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ a,n_{HCl}=0,14(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,14}{0,2}=0,7M\\ b,n_{H_2}=0,07(mol)\\ \Rightarrow V_{H_2}=0,07.22,4=1,568(l)\\ c,n_{ZnCl_2}=0,07(mol)\\ \Rightarrow m_{ZnCl_2}=0,07.136=9,52(g)\\ c,ZnCl_2+2AgNO_3\to 2AgCl\downarrow+Zn(NO_3)_2\)
\(m_{dd_{ZnCl_2}}=200.0,8+4,55-0,07.2=164,41(g)\\ n_{AgCl}=0,14(mol);n_{Zn(NO_3)_2}=0,07(mol)\\ \Rightarrow C\%_{Zn(NO_3)_2}=\dfrac{0,07.189}{164,41+200-0,14.143,5}.100\%=3,84%\)
Đúng 3
Bình luận (0)