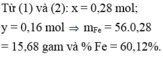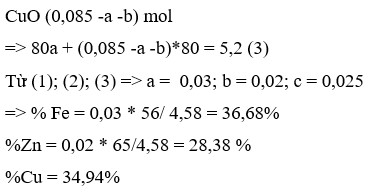Cho 6.5 g Zn và 5.6g Fe với dung dịch CuSO4 dư.Tính khối lượng chất rắn thu được

Những câu hỏi liên quan
Cho 26,08 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 27,52 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư), sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 4,48 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là A. 41,48%. B. 48,15%. C. 51,85%. D. 60,12%.
Đọc tiếp
Cho 26,08 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 27,52 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư), sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 4,48 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
A. 41,48%.
B. 48,15%.
C. 51,85%.
D. 60,12%.
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch
CuSO
4
. Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch
H
2
SO
4
loãng dư, sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là A. 58,52% B. 41,48% ...
Đọc tiếp
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO 4 . Sau một thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H 2 SO 4 loãng dư, sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
A. 58,52%
B. 41,48%
C. 48,15%
D. 51,85%
Cho 26,08 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 27,52 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư), sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 4,48 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là A. 41,48% B. 60,12% C. 51,85% D. 48,15%
Đọc tiếp
Cho 26,08 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau một thời gian, thu được dung dịch Y và 27,52 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư), sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 4,48 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
A. 41,48%
B. 60,12%
C. 51,85%
D. 48,15%
Cho hỗn hợp gồm 0,04 mol Zn và 0,03 mol Fe vào dung dịch chứa 0,1 mol CuSO4 đến phản ứng hoàn toàn, thu được dung dịch X và chất rắn Y. Cho toàn bộ X phản ứng với một lượng dư dung dịch Ba(OH)2, để kết tủa thu được trong không khí tới khối lượng không đổi cân được m gam. Giá trị của m là
Có lẽ đề cho nung kết tủa trong không khí chứ không phải "để" bạn nhỉ?
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
____0,04_____0,04_____0,04 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,03_____0,03______0,03 (mol)
⇒ nCuSO4 dư = 0,1 - 0,04 - 0,03 = 0,03 (mol)
- Dung dịch X gồm: ZnSO4: 0,04 (mol), FeSO4: 0,03 (mol) và CuSO4: 0,03 (mol)
PT: \(ZnSO_4+Ba\left(OH\right)_2\rightarrow Zn\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
______0,04__________________0,04______0,04 (mol)
\(Zn\left(OH\right)_2+Ba\left(OH\right)_2\rightarrow BaZnO_2+2H_2O\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03______0,03 (mol)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow Cu\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03_______0,03 (mol)
- Kết tủa thu được gồm: Fe(OH)2: 0,03 (mol), Cu(OH)2: 0,03 (mol) và BaSO4: 0,1 (mol)
PT: \(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
_________0,03_________0,015 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
0,03_________0,03 (mol)
⇒ m = mFe2O3 + mCuO + mBaSO4 = 0,015.160 + 0,03.80 + 0,1.233 = 28,1 (g)
Đúng 2
Bình luận (0)
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch
C
u
S
O
4
Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là A. 90,27% B. 85,30%. C. 82,20% D. 12,67%
Đọc tiếp
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch C u S O 4
Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là
A. 90,27%
B. 85,30%.
C. 82,20%
D. 12,67%
Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch
CuSO
4
Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là A. 90,27% B. 85,30%. C. 82,20% D. 12,67%
Đọc tiếp
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO 4 Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là
A. 90,27%
B. 85,30%.
C. 82,20%
D. 12,67%
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là A. 90,27%. B. 85,30%. C. 82,20%. D. 12,67%.
Đọc tiếp
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là
A. 90,27%.
B. 85,30%.
C. 82,20%.
D. 12,67%.
Đáp án A
► Đặt nZn = x; nFe = y. Do Cu2+ dư nên ta có:
– Zn + Cu2+ → Zn2+ + Cu ||⇒ tăng (65 – 64)x = x (g).
– Fe + Cu2+ → Fe2+ + Cu ||⇒ giảm (64 – 56)y = 8y (g).
Do mrắn = mkim loại ban đầu = m(g) ⇒ x = 8y.
||⇒ %mZn = 65 × 8y ÷ (65 × 8y + 56y) × 100% = 90,27%
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch C u S O 4 Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam chất rắn. Phần trăm khối lượng của Zn trong hỗn hợp bột ban đầu là
A. 90,27%
B. 85,30%.
C. 82,20%
D. 12,67%
Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%
Đúng 0
Bình luận (0)
Cho 4,58 gam hỗn hợp A gồm Zn, Fe và Cu vào cốc đựng 85 ml dung dịch
C
u
S
O
4
1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và kết tủa C. Nung C trong không khí đến khối lượng không đổi được 6 gam chất rắn D. Thêm dung dịch NaOH dư vào dung dịch B, lọc kết tủa thu được, rửa sạch rồi nung ở nhiệt độ cao đến khối lượng không đổi thu được 5,2 gam chất rắn E. Các phản ứng xảy ra hoàn toàn. % khối lượng mỗi kim loại tr...
Đọc tiếp
Cho 4,58 gam hỗn hợp A gồm Zn, Fe và Cu vào cốc đựng 85 ml dung dịch C u S O 4 1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và kết tủa C. Nung C trong không khí đến khối lượng không đổi được 6 gam chất rắn D. Thêm dung dịch NaOH dư vào dung dịch B, lọc kết tủa thu được, rửa sạch rồi nung ở nhiệt độ cao đến khối lượng không đổi thu được 5,2 gam chất rắn E. Các phản ứng xảy ra hoàn toàn. % khối lượng mỗi kim loại trong hỗn hợp A (theo thứ tự Zn, Fe, Cu) là
A. 28,38%; 36,68% và 34,94%
B. 14,19%; 24,45% và 61,36%
C. 28,38%; 24,45% và 47,17%
D. 42,58%; 36,68% và 20,74%