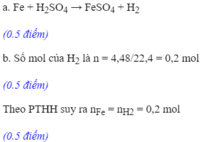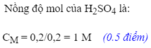Cho 2,16g bột nhôm vào 200ml dung dịch H2SO4 1M.
a) Kim loại hay axit còn dư?(Khi phản ứng kết thúc)
b) Tính thể tích khí thu được(ở đktc)
c) Tính nồng độ mol của dung dịch tạo thành sau phản ứng(Cho rằng thể tích dung dịch sau phản ứng vẫn là 200ml)