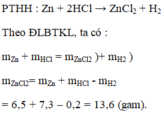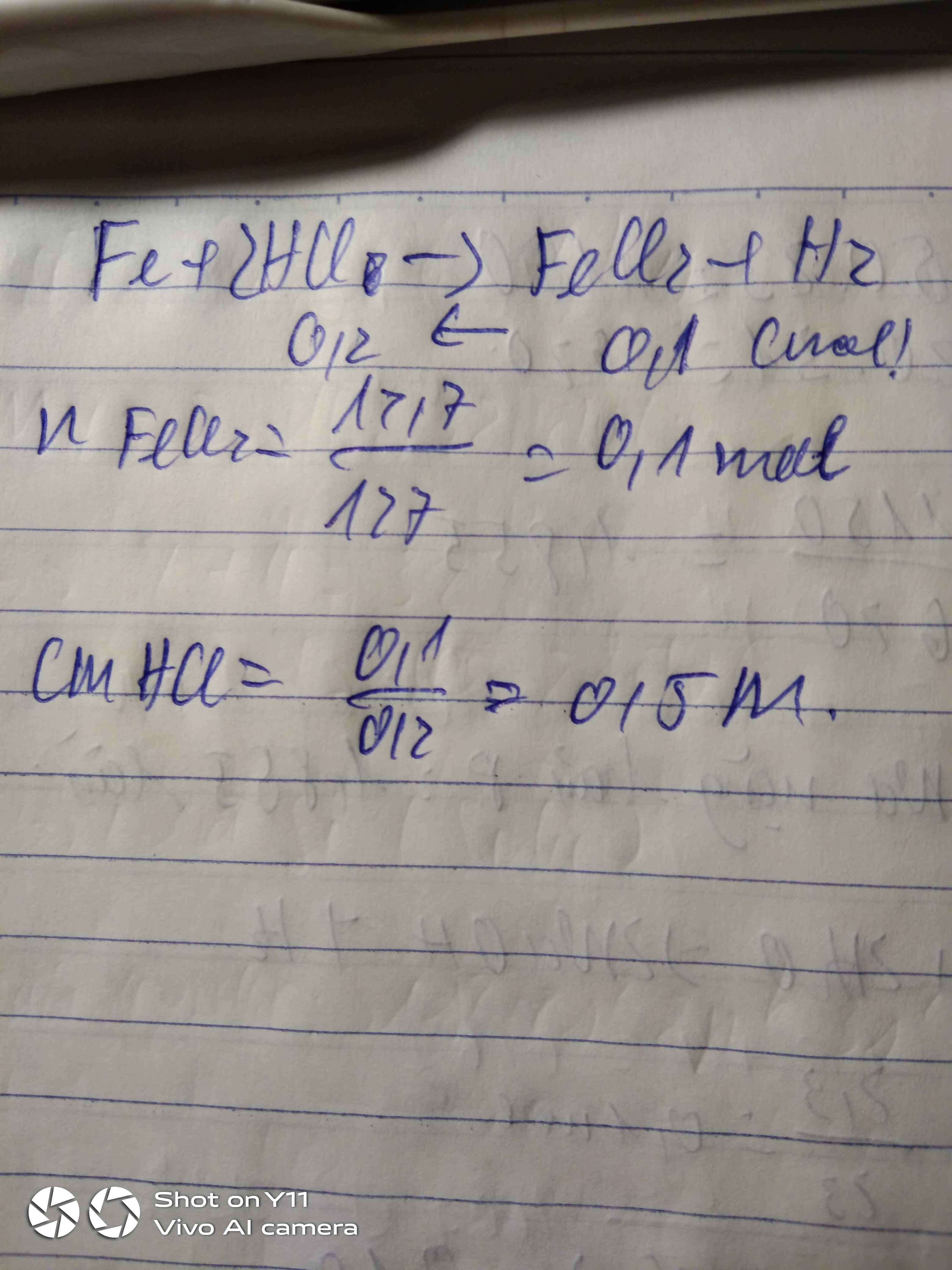Hòa tan 9,75 gam kẽm bằng 30ml dung dịch HCl 20% (d=1,825g/ml) vừa đủ. Tính nồng độ % của muối kẽn clorua trong dung dịch thu được.

Những câu hỏi liên quan
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là: A. 10,32% B. 8,72% C. 10,95% D. 10,30%
Đọc tiếp
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là:
A. 10,32%
B. 8,72%
C. 10,95%
D. 10,30%
Đặt nFe = x,nZn = y.
Khối lượng dung dịch sau phản ứng là 56x+65y+980(x+y) - 2(x+y) = 1034x+1043y
%khối lượng muối sắt = 152x/(1034x+1043y)
=> y=2x
=> % khối lượng muối kẽm = 161y/(1034x+1043y) = 10,32%
=> Đáp án A
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro.
a) Lập công thức hóa học của muối kẽm clorua. Biết kẽm clorua do hai nguyên tố là Zn và Cl tạo ra.
b) Tính khối lượng muối kẽm clorua tạo thành.
a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)
Đúng 2
Bình luận (0)
Cho kim loại kẽm tác dụng vừa đủ với dung dịch HCI 1,5M. Tính khối lượng muối kẽm clorua thu được? Biết rằng nếu thay dung dịch HCl trong phản ứng bằng dung dịch H2SO4 loãng có nồng độ mol gấp đôi thì dùng vừa đủ 100 ml. ( mọi người giúp mình với ạ)
\(n_{H_2SO_4}=0,1.3=0,3\left(mol\right)\)
PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=0,3\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{ZnCl_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow m_{ZnCl_2}=0,3.136=40,8\left(g\right)\)
Đúng 1
Bình luận (0)
Để hòa tan m gam kẽm cần vừa đủ 50g dung dịch HCl 7,3%
a) Tính m.
b) Tính thể tích khí thu được ở đktc.
c) Tính nồng độ phần trăm của dung dịch muối sau phản ứng.
a)
Zn + 2HCl → ZnCl2 + H2
nHCl = 50.7,3% = 3,65 gam
<=> nHCl = 3,65 : 36,5 = 0,1 mol
Theo tỉ lệ phản ứng => nZn = 1/2nHCl = 0,05 mol
<=> mZn = 0,05.65 = 3,25 gam.
b) nH2 = 1/2nHCl = 0,05 mol
=> VH2 = 0,05 . 22,4 = 1,12 lít.
c) m dung dịch sau phản ứng = mZn + m dd HCl - mH2 = 3,25 + 50 - 0,05.2 = 53,15 gam
mZnCl2 = 0,05.136 = 6,8 gam
<=> C% ZnCl2 = \(\dfrac{6,8}{53,15}.100\%\) = 12,8%
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 5,6 gam Fe trong dung dịch HCl 24,5% a) Tính thể tích khí hidro thu được ở điều kiện tiêu chuẩn b)Tìm khối lượng dung dịch HCl 24,5% vừa đủ để hòa tan hết lượng sắt trên c Tính nồng độ phần trăm của muối sắt 2 clorua thu được sau phản ứng biết mỗi khối lượng khí thoát ra là không đáng kể
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\
pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\\
m_{HCl}=\dfrac{\left(0,2.36,5\right).100}{24,5}=29,795\left(g\right)\\
m_{\text{dd}}=5,6+29,795-\left(0,1.2\right)=35,195\left(g\right)\\
C\%=\dfrac{0,1.127}{35,195}.100\%=36\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro,
Viết phản ứng hóa học xảy ra.
Tính khối lượng kẽm clorua Z n C l 2 tào thành.
Hòa tan hoàn toàn một kim loại M trong dung dịch HCl, cần vừa đủ 400 ml dung dịch HCl 1M, sau phản ứng thu được 50 gam dung dịch muối có nồng độ 38%. Kim loại M là
m muối=19 g
n HCl=1.0,4=0,4 mol
Đặt kim loại hóa trị 1
2M+2HCl->2MCl+H2
=>\(0,4=\dfrac{19}{M+35,5}\)
=>M =12 g\mol
Lập bảng :
n 1 2 3
M 12loại 24(nhận ) 36 loại
=>M là Mg (magie)
Đúng 2
Bình luận (0)
Hòa tan một lượng sắt vừa đủ trong 200 ml dung dịch HCl thu được dung dịch chứa 12,7 gam chất tan và khí H2. Nồng độ mol của dung dịch HCl là
Ta có PT: Fe + 2HCl ---> FeCl2 + H2.
Ta có: \(n_{FeCl_2}=\dfrac{12,7}{127}=0,1\left(mol\right)\)
Theo PT: nHCl = \(2.n_{FeCl_2}=2.0,1=0,2\left(mol\right)\)
=> mHCl = 0,2 . 36,5 = 7,3(g)
Đổi 200ml = 0,2 lít
Ta có: \(C_{M_{HCl}}=\dfrac{7,3}{0,2}=36,5\)(g/mol)
Đúng 2
Bình luận (1)
Cho 9,75 g kẽm tác dụng vừa đủ với 150 ml dung dịch HCl .để tác dụng vừa đủ với dung dịch thu được người ta dùng hết 100 gam dung dịch NaOH tính nồng độ phần trăm của dung dịch NaOH
Pt: ZnCl2 + NaOH->NaCl + Zn(OH)2