
Những câu hỏi liên quan
Một hỗn hợp khí gồm N2 và H2 có tỉ khối đối vs Hidro là 3,6.Đun nóng hh 1 thời gian rồi đưa về đk ban đầu thì đc hh ms có tỉ khối vs hidro là 4,5.
a, tính thành phần % về thể tích cảu mỗi khí trong hh trước và sau pư
b, Tính hiệu suất
Áp dụng đường chéo, ta có:
28..............................5.2
..............3.6*2...................... nN2/nH2 = 1/4
2...............................20.8
.........N2 + 3H2 <-----> 2NH3
Bđầu: 1.........4.................0
Pứ: ...x.........3x..............2x
Sau: 1-x.......4-3x............2x
Ta có: m trước = m sau => 7.2nt = 8ns
=> nt/ns = 10/9
=> 5/(5 - 2x) = 10/9
=> x = 0.25
Vậy H% = x/1 = 0.25% (tính theo N2 vì tỉ lệ bđầu so với hệ số tỉ lượng thì H2 dư nhiều hơn N2)
Đúng 1
Bình luận (0)
Một hỗn hợp khí gồm N2 và H2 có tỉ khối so với hidro là 3,6. Sau khi đun nóng hỗn hợp trên một thời gian với bột sắt thì thu được hỗn hợp N2, H2 và NH3 có tỉ khối so với hidro là 4,5. Tính phần trăm thể tích của hỗn hợp trước và sau phản ứng
Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)
Đúng 1
Bình luận (0)
Hh khi X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hh khí Y có tỉ khối so với He bằng 2. Hiệu suất của pư tổng hợp NH3 là A. 25%. B. 50%. C. 36%. D. 40%.
Đọc tiếp
Hh khi X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hh khí Y có tỉ khối so với He bằng 2. Hiệu suất của pư tổng hợp NH3 là
A. 25%.
B. 50%.
C. 36%.
D. 40%.
hh khí A(đktc) gồm có 17,92l gồm khí SO2 và O2,thỉ khối của khí A so vs H2=28.nung nóng hh vs 1 ít xt V2O5 1 thời gian vs hiệu suất đạt 75% thì thu được hh khí B.tính tỉ khối của khí B so vs h2
Một hỗn hợp A gồm H2 và N2 có tỉ khối so với H2 lầ 3,6.Nung nóng hỗn hợp 1 thời gian với xúc tác thích hợp thu đc hỗn hợp khí B gồm N2,H2,NH3 có tỉ khối so với H2 là 4,5
a) Tính % thể tích hỗn hợp trước và sau phản ứng
b) tính hiệu suất của phản ứng
Một hỗn hợp khí gồm N2 và H2 có tỉ khối so với H2 bằng 3,6. Sau khi nung nóng một thời gian với sắt bột ở 5500C thì thấy tỉ khối của hỗn hợp tăng và bằng 4,5. Tính hiện suất của phản ứng. A. 40% B. 80% C. 25% D. 50%
Đọc tiếp
Một hỗn hợp khí gồm N2 và H2 có tỉ khối so với H2 bằng 3,6. Sau khi nung nóng một thời gian với sắt bột ở 5500C thì thấy tỉ khối của hỗn hợp tăng và bằng 4,5. Tính hiện suất của phản ứng.
A. 40%
B. 80%
C. 25%
D. 50%
Đáp án D
Áp dụng phương pháp đường chéo cho hỗn hợp X:
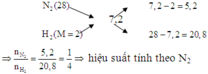
Cách 1: Đặt số mol N2 là 1 thì số mol H2 là 4 tổng số mol hỗn hợp X là 1 + 4 = 5
Thay vào công thức
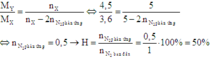
Cách 2: Áp dụng công thức tính nhanh với trường hợp x > 3y. Hiệu suất phản ứng:
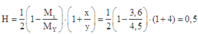
Đúng 0
Bình luận (0)
hh khí a gồm o2 và co2 có tỉ khối so với h2 laf18.4 . hh khí b gồm h2 và n2 có tỉ khối so với h2 là 10.75 cần trộn a với b ntn để có hh có tỉ khối so vs h2 là 12.6625
hh X gồm N2 và H2 có tỉ khối so với He =1,8 .đun nóng X thu được hh Y có tỉ khối so với He =2 . HIỆU SUẤT PHẢN ỨNG NH3 là
N2 + 3H2 ----> 2NH3
Gọi x, y là số mol của N2 và H2 trong hh X. Ta có: 28x + 2y = 1,8.4(x+y). Suy ra: y = 4x.
Giả sử a là số mol N2 phản ứng. Như vậy, hh Y gồm: NH3 (2a mol); H2 (4x - 3a mol); N2 (x-a mol).
Ta có: 17.2a + 2(4x-3a) + 28(x-a) = 2.4.(2a + 4x-3a + x - a).
Hay: a/x = 14/16 = 7/8.
Vậy: h = a/x = 7/8 = 87,5%.
Đúng 0
Bình luận (0)
Mx = 1.8*4 = 7.2
My = 2*4 = 8.
Lấy mhh = 7.2 g = > nX = 1 mol, nY = 7.2/8 = 0.9 mol
= > nN2 = 0.2, nH2 = 0.8. (ĐCGĐ)
N2 + 3H2 >>>>> 2NH3
1 3 2 giảm 2 mol,
Thực tế giảm 1-0.9 = 0.1 mol
= > nN2 pư = 0.1/2 = 0.05, nH2 pư = 0.15
N2 + 3H2 >>>>> 2NH3
0.2 0.8
Vì 0.2/1 < 0.8/3= > hiệu suất tính theo N2
= > H = 0.05*100%/0.2 = 25%.
= > C.
Đúng 0
Bình luận (0)
MX = 7,2. Áp dụng quy tắc đường chéo ta có: nH2:nN2=4:1nH2:nN2=4:1
⇒ Giả sử ban đầu có 4 mol H2 và 1 mol N2 trong X
N2 + 3H2 ↔ 2NH3
x → x → 2x
⇒ sau phản ứng: nY = 2x + (1 - x) + (4 - 3x) = 5 - 2x mol
Bảo toàn khối lượng: mX = mY
⇒ 5 × 7,2 = (5 - 2x) × 2 × 4
⇒ x = 0,25 mol
⇒ H% (tính theo N2) = 25%
Đúng 0
Bình luận (1)
đun nòn 0,11 mol hh khí T gồm CH4, C2H4, H2 (xúc tác Ni)sau 1 thời gian thu được 0,1 mol hh khí Q có tỉ khối so với H2 bằng 7,7
Cho Q lội qua dd Br2 dư thì có 4,8g Br2 tham gia pứ
Tính % thể tích H2 trong hh Q
\(m_Q=\left(7,7.2\right).0,1=1,54\left(g\right)\)
=> mT = 1,54 (g)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\\n_{H_2}=c\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a+b+c=0,11\left(1\right)\\16a+28b+2c=1,54\left(2\right)\end{matrix}\right.\)
ngiảm = nH2(pư) = 0,11 - 0,1 = 0,01 (mol)
\(n_{Br_2}=\dfrac{4,8}{160}=0,03\left(mol\right)\)
Bảo toàn liên kết: b = 0,01 + 0,03 = 0,04 (mol) (3)
(1)(2)(3) => a = 0,02 (mol); b = 0,04 (mol); c = 0,05 (mol)
=> nH2(Q) = 0,05 - 0,01 = 0,04 (mol)
=> \(\%V_{H_2}=\dfrac{0,04}{0,1}.100\%=40\%\)
Đúng 2
Bình luận (0)





















 Tham khảo cách làm nhé!
Tham khảo cách làm nhé!





