Tại sao ở bình thu khí clo người ta lại đặt mẩu bông tẩm dung dịch naoh loãng

Những câu hỏi liên quan
1) từ quăng pirit sắt ,nước biển , không khí hãy viết phương trình hóa học để điều chế các chất FeSO4 , FeCl3 , FeCl2 , NaHSO4.
2) khi điều chế khí Clo trong phòng thí nghiệm trước khi thu khí clo người ta dẫn khí clo thu đc qua bình đựng H2SO4 đặc và trên bình thu khí có đạy bông tẩm xút . hãy giải thích tại sao lại làm như vậy ?
Câu 1: Hỗn hợp A nặng m gam gồm Fe2O3 và Al.Nung A đến hoàn toàn thu được rắn B, choB tác dụng H2SO4 loãng thu được 2240 ml khí đktc. Mặt khác nếu cho B tác dụng với dung dịch NaOH dư thì thấy còn lại 13,6 gam chất rắn không tan.a) Xác định khối lượng các chất trong A và B.b) Tính thể tích dung dịch HCl 0,5M để hòa tan hết 13,6 gam chất rắn trên. Câu 2: Có 11,98 gam hỗn hợp X gồm Al và Fe3O4. Thực hiện phản ứng nhiệt nhôm sau một th...
Đọc tiếp
Câu 1: Hỗn hợp A nặng m gam gồm Fe2O3 và Al.Nung A đến hoàn toàn thu được rắn B, choB tác dụng H2SO4 loãng thu được 2240 ml khí đktc. Mặt khác nếu cho B tác dụng với dung dịch NaOH dư thì thấy còn lại 13,6 gam chất rắn không tan.
a) Xác định khối lượng các chất trong A và B.
b) Tính thể tích dung dịch HCl 0,5M để hòa tan hết 13,6 gam chất rắn trên.
Câu 2: Có 11,98 gam hỗn hợp X gồm Al và Fe3O4. Thực hiện phản ứng nhiệt nhôm sau một thời gian thu được rắn Y. Hòa tan Y vào dung dịch NaOH dư thu được dung dịch Z và thoát ra 2,016 lít khí (đktc). Sục khí CO2 đến dư vào dung dịch Z thu được 7,8gam kết tủa. Tính khối lượng mỗi chất trong X và Y. Tính hiệu suất phản ứng nhiệt nhôm.
giải chi tiết giúp mình với , mình cảm ơn nhiều :)))
Câu 1:
a)
Gọi \(\left\{{}\begin{matrix}n_{Fe_2O_3}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
TH1: Al dư
PTHH: Fe2O3 + 2Al --to--> Al2O3 + 2Fe
a--->2a-------->a------->2a
=> B gồm \(\left\{{}\begin{matrix}Al_2O_3:a\left(mol\right)\\Fe:2a\left(mol\right)\\Al:b-2a\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
2a------------------------>2a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
(b-2a)------------------------>1,5(b - 2a)
=> 2a + 1,5b - 3a = 0,1
=> 1,5b - a = 0,1
Rắn không tan là Fe
=> \(n_{Fe}=2a=\dfrac{13,6}{56}=\dfrac{17}{70}\left(mol\right)\)
=> \(a=\dfrac{17}{140}\left(mol\right)\) => \(b=\dfrac{31}{210}\left(mol\right)\)
Xét \(n_{Al\left(dư\right)}=b-2a=\dfrac{-2}{21}\) (vô lí)
TH2: Fe2O3 dư
PTHH: Fe2O3 + 2Al --to--> Al2O3 + 2Fe
0,5b<---b--------->0,5b---->b
=> B gồm \(\left\{{}\begin{matrix}Al_2O_3:0,5b\left(mol\right)\\Fe:b\left(mol\right)\\Fe_2O_3:a-0,5b\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
b------------------------>b
=> b = 0,1
Rắn không tan gồm Fe và Fe2O3
=> \(56b+160\left(a-0,5b\right)=13,6\)
=> a = 0,1
A gồm \(\left\{{}\begin{matrix}Fe_2O_3:m_{Fe_2O_3}=0,1.160=16\left(g\right)\\Al:m_{Al}=0,1.27=2,7\left(g\right)\end{matrix}\right.\)
B gồm \(\left\{{}\begin{matrix}Al_2O_3:m_{Al_2O_3}=0,05.102=5,1\left(g\right)\\Fe:m_{Fe}=0,1.56=5,6\left(g\right)\\Fe_2O_3:m_{Fe_2O_3}=0,05.160=8\left(g\right)\end{matrix}\right.\)
b)
Rắn không tan gồm \(\left\{{}\begin{matrix}Fe:0,1\left(mol\right)\\Fe_2O_3:0,05\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1-->0,2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
0,05---->0,3
=> nHCl = 0,2 + 0,3 = 0,5 (mol)
=> \(V_{ddHCl}=\dfrac{0,5}{0,5}=1\left(l\right)\)
Đúng 3
Bình luận (0)
Câu 2:
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)\)
Gọi số mol Al2O3 là x (mol)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,06<---------------------0,06<--------0,09
Al2O3 + 2NaOH --> 2NaAlO2 + H2O
x------------------>2x
2NaAlO2 + CO2 + 3H2O --> Na2CO3 + 2Al(OH)3
0,1<-------------------------------------0,1
=> 0,06 + 2x = 0,1
=> x = 0,02 (mol)
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
Có \(\dfrac{n_{Al_2O_3}}{n_{Fe}}=\dfrac{4}{9}\)
=> nFe = 0,045 (mol)
mY = mX = 11,98 (g)
=> \(m_{Al_2O_3}+m_{Al\left(Y\right)}+m_{Fe}+m_{Fe_3O_4\left(Y\right)}=11,98\)
=> \(m_{Fe_3O_4\left(Y\right)}=5,8\left(g\right)\)
=> \(n_{Fe_3O_4\left(Y\right)}=\dfrac{5,8}{232}=0,025\left(mol\right)\)
Bảo toàn Fe: \(n_{Fe_3O_4\left(bđ\right)}=0,04\left(mol\right)\)
Bảo toàn Al: nAl(bđ) = 0,1 (mol)
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
Xét tỉ lệ: \(\dfrac{0,1}{8}< \dfrac{0,04}{3}\) => Hiệu suất tính theo Al
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
0,04<------------------0,02
=> \(H\%=\dfrac{0,04}{0,1}.100\%=40\%\)
Đúng 2
Bình luận (2)
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là: A. 38,72 B. 35,50 C. 49,09 D. 34,36
Đọc tiếp
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72
B. 35,50
C. 49,09
D. 34,36
Đáp án A
Quy đổi hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 thành Fe và Fe2O3.
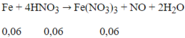


Vậy muối = (0,1 + 0,06).242 = 38,72 (g)
Đúng 0
Bình luận (0)
Một người gõ mạnh búa xuống đường ray xe lửa tại điểm A . Hai người khác đứng tại điểm B cách A 1530m . Một người đặt tai xuống đường ray nghe được âm thanh của tiếng búa gõ sớm hơn một người đặt tai ngoài không khí để nghe âm thanh của tiếng búa gõ là 4,245s . Tìm vận tốc âm thanh truyền trong đường ray . Biết vận tốc âm thanh truyền trong không khí là 340m/s . Giải thích tại sao gõ một lại nghe hai tiếng .....
Đọc tiếp
Một người gõ mạnh búa xuống đường ray xe lửa tại điểm A . Hai người khác đứng tại điểm B cách A 1530m . Một người đặt tai xuống đường ray nghe được âm thanh của tiếng búa gõ sớm hơn một người đặt tai ngoài không khí để nghe âm thanh của tiếng búa gõ là 4,245s . Tìm vận tốc âm thanh truyền trong đường ray . Biết vận tốc âm thanh truyền trong không khí là 340m/s . Giải thích tại sao gõ một lại nghe hai tiếng .....
Thời gian người đặt tai ngoài không khí để nghe là:
\(1530:340=4,5\)( giây)
Thời gian người đặt tai xuống đường ray để nghe là:
\(4,5-4,245=0,255\)(giây)
Vận tốc người đặt tai xuống đường ray để nghe là:
\(1530:0,255=6000\)(m/s)
Có thể gõ 1 mà nghe 2 tiếng vì khi gõ mạnh búa xuống đường ray thì âm truyền đi cả trong không khí và trong đường ray nên ta có thể gõ 1 mà nghe lại 2 tiếng.
Đúng 1
Bình luận (0)
hòa tan 5,67g Mg trong dung dịch HNO3 loãng dư thì thu được dung dịch B và 0,896 lít khí một khí X. Cô cạn dung dịch B thu được 37,12 gam chất rắn. Xác định khí X
Hỗn hợp A có khối lượng 6,1g gồm CuO, Al2O3 và FeO. Hòa tan hoàn toàn A cần 130ml dung dịch H2SO4 loãng 1M, thu được dung dịch B.Cho dung dịch B tác dụng với dung dịch NaOH dư, lọc lấy kết tủa đen nung trong không khí đến khối lượng không đổi, được 3,2g chất rắn.Tính khối lượng từng oxit trong A.giúp em với ạ. giup
Đọc tiếp
Hỗn hợp A có khối lượng 6,1g gồm CuO, Al2O3 và FeO. Hòa tan hoàn toàn A cần 130ml dung dịch H2SO4 loãng 1M, thu được dung dịch B.Cho dung dịch B tác dụng với dung dịch NaOH dư, lọc lấy kết tủa đen nung trong không khí đến khối lượng không đổi, được 3,2g chất rắn.
Tính khối lượng từng oxit trong A.
giúp em với ạ.
giup
Gọi x,y,z là số mol của \(CuO, Al_2O_3, FeO\)
=> \(80x+102y+72z=6,1\)(1)
A + \(H_2SO_4\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
=>x+3y+z=0,13 (2)
B+NaOH dư, lấy kết tủa nung trong không khí
=>Chất rắn là CuO và Fe2O3 do kết tủa của nhôm tan hết trong NaOH dư
\(BTNT(Cu):\)\(n_{CuO}=x\left(mol\right)\)
\(BTNT\left(Fe\right):n_{Fe_2O_3}=\dfrac{1}{2}n_{FeO}=\dfrac{z}{2}\)
=> 80x+\(160.\dfrac{z}{2}\)=3,2 (3)
Từ (1), (2), (3)=>x=0,02 ; y=0,03; z=0,02
\(\Rightarrow m_{CuO}=1,6\left(g\right);m_{Al_2O_3}=3,06\left(g\right);m_{FeO}=1,44\left(g\right)\)
Đúng 2
Bình luận (0)
Giúp em câu này với: Khí oxi nặng hơn không khí bao nhiêu lần? Từ đó, hãy cho biết để thu khí hidro vào bình bằng cách đẩy không khí, ta phải đặt đứng bình hay đặt ngược bình?Vì sao?
TL:
Khí O2 có khối lượng là 32 g/mol. Con kk có khối lượng trung bình là 29. Vì vậy O2 nặng hơn kk 32/29 = 1,1 lần.
Để thu khí H2 vào bình bằng cách đẩy kk thì phải đặt ngược bình vì H2 nhẹ hơn kk sẽ bay lên trên.
Đúng 0
Bình luận (0)
Cho 18,5 gam hỗn hợp Z gồm Fe và Fe3O4 tác dụng với 200ml dung dịch HNO3 loãng, đun nóng, khuấy đều. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch Z1 và còn lại 1,46 gam kim loại.
a. Viết các PTHH xảy ra.
b. Tính nồng độ mol của dung dịch HNO3 đã dùng.
c. Tính khối lượng muối trong dung dịch Z1.
Gọi \(\left\{{}\begin{matrix}n_{Fe_3O_4}=a\left(mol\right)\\n_{Fe\left(pư\right)}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
3Fe3O4 + 28HNO3 ---> 3Fe(NO3)3 + NO + 14H2O
a 28a/3 3a a/3
Fe + 4HNO3 ---> Fe(NO3)3 + NO + 2H2O
b 4b b b
Fe + 2Fe(NO3)3 ---> 3Fe(NO3)2
(1,5a + 0,5b)->(3a + b)->(4,5a + 1,5b)
Hệ pt \(\left\{{}\begin{matrix}56\left(b+0,5b+1,5a\right)+232a+1,46=18,5\\\dfrac{a}{3}+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,03\left(mol\right)\\b=0,09\left(mol\right)\end{matrix}\right.\)
\(\rightarrow C_{M\left(HNO_3\right)}=\dfrac{\dfrac{28.0,03}{3}+0,09.4}{0,2}=3,2M\)
=> \(m_{Fe\left(NO_3\right)_2}=\left(4,5.0,03+1,5.0,09\right).180=48,6\left(g\right)\)
Đúng 2
Bình luận (0)
Thực hiện các thí nghiệm sau:(1) Đốt dây sắt trong khí clo.(2) Đốt nóng hỗn hợp bột
Fe
và
S
(trong điều kiện không có oxi).(3) Cho
FeO
vào dung dịch
HNO
3
(loãng dư).(4) Cho
Fe
vào dung dịch
Fe
2
SO
4
3
.(5) Cho
Fe...
Đọc tiếp
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo.
(2) Đốt nóng hỗn hợp bột Fe và S (trong điều kiện không có oxi).
(3) Cho FeO vào dung dịch HNO 3 (loãng dư).
(4) Cho Fe vào dung dịch Fe 2 SO 4 3 .
(5) Cho Fe vào dung dịch H 2 SO 4 (loãng, dư).
Có bao nhiêu thí nghiệm tạo ra muối sắt(II)?
A. 3.
B. 1.
C. 2.
D. 4.
Đáp án A
Các phản ứng tạo ra muối sắt(II) là :
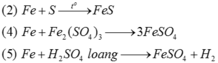
Hai phản ứng còn lại đều tạo ra muối sắt(III).
Đúng 0
Bình luận (0)


















