Bình gaz có chứa 12 kg khí C4H10 đc nén ở áp suất cao. Tính khối lượng khí oxi cần dùng và khối lượng khí CO2 thoát ra khi gaz trong bình cháy hết?

Những câu hỏi liên quan
Bình ga dùng để đun nấu trong gia đình có chứa 13,05 kg butan (C4H10) ở trạng thái lỏng do được nén dưới áp suất cao. Tính khối lượng không khí cần dùng để đốt hết nhiên liệu có trong bình. Biết oxi chiếm 23% khối lượng của không khí.
MÌNH MỚI HỌC LỚP 5 THÔI
Đang dạo box Sinh thì thấy bài Hoá:
Đổi 13,05 kg = 13050 g
\(n_{C_4H_{10}}=\dfrac{13050}{58}=225\left(mol\right)\)
PTHH: 2C4H10 + 13O2 \(\underrightarrow{t^o}\) 8CO2 + 10H2O
225 1462,5
=> mO2 = 1462,5 . 32 = 46800 (g)
=> mkk = \(\dfrac{46800}{23\%}=203478,3\left(g\right)\)
Đúng 1
Bình luận (0)
Bình đựng ga dùng để đun nấu trong gia đình có chứa 12,5 kg butan
C
4
H
10
ở trạng thái lỏng, do được nén dưới áp suất cao.Tính thể tích không khí cần ở đktc dùng để đốt cháy hết lượng nhiên liệu có trong bình ( biết oxi chiếm khoảng 20% thể tích không khí, phản ứng cháy butan cho
C
O
2
và
H...
Đọc tiếp
Bình đựng ga dùng để đun nấu trong gia đình có chứa 12,5 kg butan C 4 H 10 ở trạng thái lỏng, do được nén dưới áp suất cao.
Tính thể tích không khí cần ở đktc dùng để đốt cháy hết lượng nhiên liệu có trong bình ( biết oxi chiếm khoảng 20% thể tích không khí, phản ứng cháy butan cho C O 2 và H 2 O ).
bình đựng gaz dùng để đun nấu trong gia điinhf có chứa 13,05 C4H10 ở thể lỏng do được nén dưới áp suất cao. Tính thể tích không khí cần thiết để đốt cháy hết lượng butan có trong bình biết oxi chiếm 20% về thể tích của không khí
giúp tôi![]()
e phải ghi rõ 13.05,đại lượng j mới được chứ
Đúng 0
Bình luận (0)
nC4H10=\(\frac{13,05}{58}\)= O,225 mol
2C4H10 +13 O2 → 8CO2 + 10H2
0,225 → 1,4625mol
VO2= 1,4625 . 22,4 = 32,76 l
Vì VO2= 20% VKK
suy ra: VKK= 32,76 .5 = 163,8l
bình đựng gas dùng để đun nấu trong gia đình có chứa 13,05 butan(C4H10) ở thể lỏng do được nén dưới áp suất cao tính thể tích không khí cần thiết để đốt cháy hết lượng butan có trong bình biết oxi chếm 20 phần trăm về thể tích của không khí
giúp mình với nha
nC4H10=\(\frac{13.05}{58}\)= O,225 mol
2C4H10 +13 O2 → 8CO2 + 10H2
0,225 → 1,4625mol
VO2= 1,4625 . 22,4 = 32,76 l
Vì VO2= 20% VKK
suy ra: VKK= 32,76 .5 = 163,8l
Đúng 0
Bình luận (0)
Một bình chứa ôxi
(
O
2
)
nén ở áp suất và nhiệt độ có khối lượng (bình và khí) . Dùng khí một thời gian, áp kế chỉ và nhiệt độ , khối lượng của bình và khí . Hỏi còn bao nhiêu kg khí trong bình ? Tính thể tích V của bình A. 0,58kg ; 8,4l B. 0,85kg ;4,8l C. 5kg ;7l D. 3,7kg; 15l
Đọc tiếp
Một bình chứa ôxi
(
O
2
)
nén ở áp suất ![]()
và nhiệt độ ![]()
có khối lượng (bình và khí) ![]() .
.
Dùng khí một thời gian, áp kế chỉ ![]()
và nhiệt độ ![]() , khối lượng của bình và khí
, khối lượng của bình và khí
![]() . Hỏi còn bao nhiêu kg khí trong bình ? Tính thể tích V của bình
. Hỏi còn bao nhiêu kg khí trong bình ? Tính thể tích V của bình
A. 0,58kg ; 8,4l
B. 0,85kg ;4,8l
C. 5kg ;7l
D. 3,7kg; 15l
Đáp án A
Gọi ![]()
lần lượt là khối lượng ôxi trong bình nước và sau khi dùng:

Mặt khác ![]()
suy ra ![]()
Ghi chú: khi giải bài này ta đã coi khí ôxi ở áp suất 150 atm vẫn là lí tưởng, vì thế kết quả chỉ gần đúng (sai lệch có thể đến cỡ 5%)
Đúng 0
Bình luận (0)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 70. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 170C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m1, m2 là khối lượng khí trong bình trước và sau khi nung nóng bình. Áp dụng phương trình Menđêlêep – Clapêrôn ta có:
p V = m 1 μ R T 1 , p V = m 2 μ R T 2 . ⇒ m 2 − m 1 = p V μ R ( 1 T 1 − 1 T 2 )
Với p = 50atm, V = 10 lít, μ = 2 g
R = 0 , 082 ( a t m . l / m o l . K ) Mà T 1 = 273 + 7 = 280 K ; T 2 = 273 + 17 = 290 K
⇒ m 2 − m 1 = 50.10.2 0 , 082 ( 1 280 − 1 290 ) m 2 - m 1 = 1 , 502 ( g )
Đúng 0
Bình luận (0)
Một bình có dung tích V = 10 lít chứa một lượng khí hiđrô bị nén ở áp suất p = 50atm và nhiệt độ 7 ° . Khi nung nóng bình, do bình hờ nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17 ° C và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi m i , rrn là khối lượng khí trong bình trước và sau khi nung nóng bình.
Áp dụng phương trình Menđêlêep - Clapêrôn ta có:
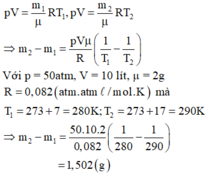
Đúng 0
Bình luận (0)
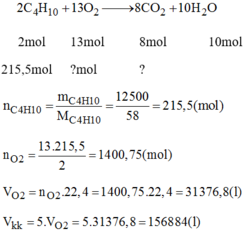
Bình đựng ga dùng để đun nấu trong gia đình có chứa 12,5 kg butan ( C4H10 ) ở trạng thái lỏng , do nén được áp suất cao .a ) Tính thể tích không khí cần ở dùng đktc để đốt cháy hết lượng nhiên liệu có trong bình( biết oxi chiếm khoảng 20% thể tích không khí , phản ững của butan cho CO2 và H2O ) .b ) Thể tích CO2 ( đktc ) sinh ra là bao nhiêu ? Để không khí tỏng phòng đươc thoáng ta phải làm gì ?
Đọc tiếp
Bình đựng ga dùng để đun nấu trong gia đình có chứa 12,5 kg butan ( C4H10 ) ở trạng thái lỏng , do nén được áp suất cao .
a ) Tính thể tích không khí cần ở dùng đktc để đốt cháy hết lượng nhiên liệu có trong bình( biết oxi chiếm khoảng 20% thể tích không khí , phản ững của butan cho CO2 và H2O ) .
b ) Thể tích CO2 ( đktc ) sinh ra là bao nhiêu ? Để không khí tỏng phòng đươc thoáng ta phải làm gì ?
\(n_{C_4H_{10}}=\frac{12500}{58}=215,5\left(mol\right)\)
Phương trình hóa học :
\(2C_4H_{10}+13O_2\rightarrow8CO_2+10H_2O\)
\(2mol\) \(13mol\) \(8mol\)
\(215,5mol\) \(x\) \(mol\rightarrow y\) \(mol\)
a ) \(x=\frac{13\times215,5}{2}=1400,75\left(mol\right)\)
\(V_{kk}=\frac{1400,75\times100\times22,4}{20}=156884\left(lít\right).\)
b ) \(y=\frac{215,5\times8}{2}=862\left(mol\right).\)
\(\rightarrow V_{CO_2}=862\times22,4=19308,8\left(lít\right).\)
Để khong khí trong phòng được thoáng ta cần có máy hút gió trên bếp hoặc mở các của trong bếp ăn .
Đúng 0
Bình luận (0)
Một bình có dung tích V=10 lít chứa một lượng khí hidro bị nén ở áp suất p=50at,7oC. Khi nung nóng bình, do bình hở nên có một phần khí thoát ra; phần khí còn lại có nhiệt độ 17oC và vẫn dưới áp suất như cũ. Tính khối lượng khí đã thoát ra.
Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Đúng 0
Bình luận (0)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g
Đúng 0
Bình luận (0)