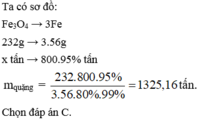Cần bao nhiêu tấn quặng có chứa 80% Fe2O3 để có 1,5 tấn Fe

Những câu hỏi liên quan
Cần bao nhiêu tấn quặng hematit chứa 85% Fe2O3 để có một lượng sắt bằng lượng sắt có trong 2,4 tấn muối chứa trong 80% muối sắt (II) sunphat
từ 100 tấn quặng hemantic chứa 80% Fe2O3 sản xuất được bao nhiêu tấn Fe.(H=60%)
\(m_{Fe_2O_3}=100000.80\%=80000(kg)\\ \Rightarrow n_{Fe_2O_3}=\dfrac{80000}{160}=500(kmol)\\ PTHH:Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\\ \Rightarrow n_{Fe}=2n_{Fe_2O_3}=1000(kmol)\\ \Rightarrow m_{Fe}=1000.56=56000(kg)\\ \Rightarrow m_{Fe(\text {Thực tế})}=56000.60\%=33600(kg)=33,6(tấn)\)
Đúng 1
Bình luận (0)
Cần bao nhiêu tấn quặng manhetit chứa 80% F e 3 O 4 để có thể luyện được 800 tấn gang có hàm lượng 95%. Lượng Fe hao hụt trong sản xuất là 1%.
A. 2351,16 tấn.
B. 3512,61 tấn.
C. 1325,16 tấn.
D. 5213,61 tấn.
Cần bao nhiêu tấn quặng manhetit chứa 80% F e 3 O 4 để có thể luyện được 800 tấn gang có hàm lượng 95%? Biết lượng Fe hao hụt trong sản xuất là 1%.
A. 5213,61 tấn.
B. 1325,16 tấn.
C. 3512,61 tấn.
D. 2351,16 tấn.
Dùng 12 tấn quặng hematit có chứa 85% Fe2O3 để luyện gang (chứa 96% Fe). Hiệu suất quá trình phản ứng là 80%. Khối lượng gang thu được là bao nhiêu.
Giúp e vs ạ, em cần gấp
\(m_{Fe_2O_3}=12000.85\%=10200(kg)\\ \Rightarrow n_{Fe_2O_3}=\dfrac{10200}{160}=63,75(kmol)\\ \Rightarrow n_{Fe_2O_3(p/ứ)}=63,75.80\%=51(kmol)\\ \Rightarrow n_{Fe}=2n_{Fe_2O_3}=102(kmol)\\ \Rightarrow m_{Fe}=102.56=5712(kg)\\ \Rightarrow m_{gang}=\dfrac{5712}{96\%}=5950(kg)=5,95(tấn)\)
Đúng 2
Bình luận (0)
Giúp mình với : Để thu được 1 tấn gang có chứa 95% iron thì cần bao nhiêu tấn quặng có chứa 90% Fe2O3.
Tính khối lượng khí CO2 đã sinh ra
\(m_{Fe}=1000.95\%=950(kg)\\ \Rightarrow n_{Fe}=\dfrac{950}{56}=\dfrac{475}{28}(kmol)\\ PTHH:Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\\ \Rightarrow n_{Fe_2O_3}=2n_{Fe}=\dfrac{475}{14}(kmol)\\ \Rightarrow m_{Fe_2O_3}=\dfrac{475}{14}.160=5428,57(kg)\\ \Rightarrow m_{quặng}=\dfrac{5428,57}{90\%}\approx6030(kg)=6,03(tấn)\\ n_{CO_2}=\dfrac{3}{2}n_{Fe}=\dfrac{1425}{56}(kmol)\\ \Rightarrow m_{CO_2}=\dfrac{1425}{56}.44\approx1100(kg)=1,1(tấn)\)
Đúng 1
Bình luận (0)
1: Một tấn quặng chứa 90% Fe2O3. a)tính khối lượng Fe2O3 có trong 1 tấn quặng trên. b)tính khối lượng Fe thu được nếu khử 1 tấn quặng trên bằng hidro.Biết hidro phản ứng khử 90% c)để thu được 1 tấn fe,tính khối lượng quặng cần lấy nếu hidro pứ...
Đọc tiếp
1: Một tấn quặng chứa 90% Fe2O3. a)tính khối lượng Fe2O3 có trong 1 tấn quặng trên. b)tính khối lượng Fe thu được nếu khử 1 tấn quặng trên bằng hidro.Biết hidro phản ứng khử = 90% c)để thu được 1 tấn fe,tính khối lượng quặng cần lấy nếu hidro pứ = 80% 2:tính khối lượng KMnO4 cần lấy để điều chế được 3,308l oxi (đktc).Biết hidro pứ = 90%
mFe2O3=1.90%=0,9(tấn)
b; Fe2O3 + 3H2 -> 2Fe + 3H2O (1)
160 tấn 112 tấn
0,9 tấn a tấn
=>a=\(\dfrac{0,9.112}{160}=0,63\)(tấn)
mFe thu dc=0,63.90%=0,567(tấn)
c; Fe2O3 + 3H2 -> 2Fe + 3H2O (1)
160 tấn 112 tấn
a tấn 1 tấn
a=\(\dfrac{160}{112}=1,43\)(tấn)
mFe2O3 cần lấy=1,43:80%=1,8(tấn)
Đúng 0
Bình luận (4)
Quặng A có 42% Fe2O3.Quặng B có 60% FeS2.Trộn A và B theo tỉ khối bằng bao nhiêu để được hỗn hợp C,mà trong 1 tấn C sẽ chứa 284kg Fe
Để có 1 tấn thép (98% Fe) cần dùng bao nhiêu tấn quặng hematit nâu ( Fe 2 O 3 . 2 H 2 O ) ? Hàm lượng hematit nâu trong quặng là 80%. Hiệu suất quá trình phản ứng là 93%.
Khối lượng Fe: 1x98/100 = 0,98 tấn
Trong 196 tấn ( Fe 2 O 3 . 2 H 2 O ) có 112 tấn Fe
Trong 0,98 tấn Fe có 1,715 tấn ( Fe 2 O 3 . 2 H 2 O )
Khối lượng quặng : 1,715 x 100/80 = 2,144 tấn
Khối lượng quặng thực tế cần dùng: 2,144 x 100/93 = 2,305 tấn
Đúng 0
Bình luận (0)