giải thích tại sao trong cùng điều kiện nhiệt độ và áp suất 1 mol khí hidro (2gH2) và 1 mol khí cacbonis (44g CO2) có thể tích bằng nhau

Những câu hỏi liên quan
Hỗn hợp khí X gồm (CH4 ,CO2 ,O2) cùng đo ở điều kiện nhiệt độ và áp suất ,trong đó tỉ lệ số mol CH4 và CO2 lần lượt là 1:1 biết tỉ khối hỗn hợp X so với Hidro là 15,5
-tính phần trăm thể tích mỗi khí ý trong hỗn hợp X
-Tính phần trăm khối lượng mỗi khí trong hỗn hợp X
Hỗn hợp khí X gồm (CH4 ,CO2 ,O2) cùng đo ở điều kiện nhiệt độ và áp suất ,trong đó tỉ lệ số mol CH4 và CO2 lần lượt là 1:1 biết tỉ khối hỗn hợp X so với Hidro là 15,5
-tính phần trăm thể tích mỗi khí ý trong hỗn hợp X
-Tính phần trăm khối lượng mỗi khí trong hỗn hợp X
Phát biểu nào sau đây là KHÔNG đúng *1 điểmThể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó.Trong cùng điều kiện về nhiệt độ và áp suất, thể tích mol của các chất khí khác nhau đều bằng nhau.Ở điều kiện tiêu chuẩn (0oC, 1 atm), 0,5 mol chất khí chiếm thể tích là 11,2 lít.Thể tích mol chiếm bởi 1 mol chất khí là 22,4 lít.
Đọc tiếp
Phát biểu nào sau đây là KHÔNG đúng *
1 điểm
Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó.
Trong cùng điều kiện về nhiệt độ và áp suất, thể tích mol của các chất khí khác nhau đều bằng nhau.
Ở điều kiện tiêu chuẩn (0oC, 1 atm), 0,5 mol chất khí chiếm thể tích là 11,2 lít.
Thể tích mol chiếm bởi 1 mol chất khí là 22,4 lít.
Giải thích vì sao ở cùng điều kiện nhiệt độ và áp suất, những thể tích bằng nhau của mọi chất khí đều chứa cùng số phân tử khí. Điều đó có thể áp dụng cho chất lỏng được không? Vì sao?
Vì thể tích 1 mol chất phụ thuộc vào kích thước của phân tử và khoảng cách giữa các phân tử của chất, mà các chất khác nhau thì có phân tử với kích thước và khoảng cách giữa chúng khác nhau.
Đúng 1
Bình luận (0)
TK#
Đối với chất khí do lực hút phân tử các chất khí rất yếu nên khoảng cách giữa các phân tử rất lớn. Thể tích không phụ thuộc vào kích thước phân tử mà chỉ phụ thuộc vào khoảng cách phân tử. Khi tác động cùng điều kiện nhiệt độ và áp suất thì khoảng cách giữa các phân tử chất khí khác nhau thì bằng nhau nên số phân tử bằng nhau ⇒ Thể tích bằng nhau.
Đúng 2
Bình luận (0)
Ở cùng điều kiện như nhau về nhiệt độ và áp suất ,đối với chất khí có cùng số mol có cùng thể tích còn vs chất lỏng và rắn thì cùng số mol k cùng thể tích
Bạn giở lại sgk Lý 7, bài sự nở ra vì nhiệt của các chất:)
Đúng 2
Bình luận (0)
Phát biểu nào dưới đây là sai?A. Một mol của của bất kì chất khí nào, trong cùng điều kiện nhiệt độ và áp suất phải chiếm những thể tích bằng nhau.B. Thể tích của 1 mol chất khí bất kì luôn có giá trị là 22,4 lít.C. Khối lượng mol nguyên tử của một chất là khối lượng tính bằng gam của 6.1023 nguyên tử chất đó.D. Thể tích mol của chất khí là thể tích chiếm bởi 6.1023 phân tử chất khí đó
Đọc tiếp
Phát biểu nào dưới đây là sai?
A. Một mol của của bất kì chất khí nào, trong cùng điều kiện nhiệt độ và áp suất phải chiếm những thể tích bằng nhau. |
B. Thể tích của 1 mol chất khí bất kì luôn có giá trị là 22,4 lít. |
C. Khối lượng mol nguyên tử của một chất là khối lượng tính bằng gam của 6.1023 nguyên tử chất đó. |
D. Thể tích mol của chất khí là thể tích chiếm bởi 6.1023 phân tử chất khí đó |
Chọn B vì thể tích còn phải tùy thuộc vào áp suất và nhiệt độ, phải cùng nhiệt độ và áp suất mới có thể tích bằng nhau
Đúng 1
Bình luận (0)
Điều kiện tiêu chuẩn : nhiệt độ .......... , áp suất ............ -
Thể tích mol phân tử của chất khí là thể tích chứa .......... phân tử khí hay ......... mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng ......... lít.
- Người ta quy ước điều kiện thường là ở nht độ .......... và áp suất ......... atm.
Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm.
Thể tích mol phân tử của chất khí là thể tích chứa 6,022.1023 phân tử khí hay 1 mol chất khí.
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.
Đúng 1
Bình luận (0)
Điều kiện tiêu chuẩn : nhiệt độ 0oC , áp suất 1 atm
Thể tích mol phân tử của chất khí là thể tích chứa 6.1023 phân tử khí hay 1 mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng 22,4 lít.
- Người ta quy ước điều kiện thường là ở nht độ 20oC và áp suất 1 atm.
Đúng 1
Bình luận (1)
Điều kiện tiêu chuẩn : nhiệt độ ....0oC...... , áp suất ..1atm.......... -
Thể tích mol phân tử của chất khí là thể tích chứa ....6 * 1023...... phân tử khí hay ....1..... mol chất khí. -
Ở đktc , thể tích của 1 mol chất khí bằng ...22,4...... lít.
- Người ta quy ước điều kiện thường là ở nhiệt độ ....20oC...... và áp suất ....1..... atm.
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hãy tính thể tích chất khí ở điều kiện tiêu chuẩn (250C và áp suất 1 bar) có trong 0,6 mol khí Hidro
Một khí cầu có thể tích V 336
m
3
và khối lượng vỏ m 84 kg được bơm không khí nóng tới áp suất bằng áp suất không khí bên ngoài. Không khí nóng phải có nhiệt độ bằng bao nhiêu để khí cầu bắt đầu bay lên ? Biết không khí bên ngoài có nhiệt độ 27
°
C và áp suất 1 atm ; khối lượng mol của không khí ở điều kiện chuẩn là 29.
10
3
kg/mol.
Đọc tiếp
Một khí cầu có thể tích V = 336 m 3 và khối lượng vỏ m = 84 kg được bơm không khí nóng tới áp suất bằng áp suất không khí bên ngoài. Không khí nóng phải có nhiệt độ bằng bao nhiêu để khí cầu bắt đầu bay lên ? Biết không khí bên ngoài có nhiệt độ 27 ° C và áp suất 1 atm ; khối lượng mol của không khí ở điều kiện chuẩn là 29. 10 3 kg/mol.
Gọi ρ 1 và ρ 2 là khối lượng riêng của không khí ở nhiệt độ T 1 = 27 + 273 = 300 K và nhiệt độ T 2 là nhiệt độ khi khí cầu bắt đầu bay lên.
Khi khí cầu bay lên:
F Á c - s i - m é t = P v ỏ k h í c ầ u + P c ủ a k h ô n g k h í n ó n g
ρ 1 gV = mg + ρ 2 gV
ρ 2 = ρ 1 – m/V (1)
Ở điều kiện chuẩn, khối lượng riêng của không khí là:
ρ 0 = 29g/22,4l = 1,295g/ d m 3 = 1,295kg/ m 3
Vì thể tích của một lượng khí tỉ lệ thuận với nhiệt độ tuyệt đối khi áp suất không đổi nên khối lượng riêng của một lượng khí tỉ lệ nghịch với nhiệt độ tuyệt đối khi áp suất không đổi.
Ta có: ρ 1 = T 0 ρ 0 / T 1 (2)
Từ (1) và (2) suy ra: ρ 1 = 1,178 kg/ m 3
Do đó ρ 2 = 0,928 kg/ m 3
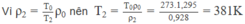
t 2 = 108 ° C
Đúng 0
Bình luận (0)
























