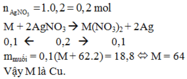Cho m gam kim loại M hoà tan hoàn toàn trong 100 ml dung dịch HCl 0,1M (D= 1,05 g/ml) được dd X có khối lượng là 105,11 gam . Xđ m và M biết kim loại M có hoá trị I đến III

Những câu hỏi liên quan
Cho m gam kim loại M hoà tan hoàn toàn trong 100 ml dung dịch HCl 0,1M (D = 1,05 g/ml) được dung dịch X có khối lượng là 105,11 gam. Xác định m và M, biết rằng kim loại có hoá trị từ I đến III.
Khối lượng dung dịch HCl :
m dd = V x D = 100 x 1,05 = 105 (gam)
n HCl = 0,1 x 0,1 = 0,01 (mol)
Gọi hoá trị của kim loại M là n
Phương trình hoá học của phản ứng :
2M + 2nHCl → 2 MCl n + n H 2 (1)
Áp dụng định luật bảo toàn khối lượng
m + m HCl = m muối + m H 2
m = 105,11 + 0,01/2 x 2 - 105 = 0,12g
Theo phương trình hóa học (1) :
n M = 0,01/n mol → 0,01/n x M = 0,12 → M = 12n
Kẻ bảng
| n | 1 | 2 | 3 |
| M | 12 | 24 | 36 |
| loại | nhận | loại |
Vậy kim loại M là Mg.
Đúng 1
Bình luận (0)
a,Cho 100ml dung dịch HCL 0,1M(Khối lượng riêng d1,05g/mol) hòa tan vừa đủ m gam kim loại M cho ra dung dịch có khối lượng là 105,11 gam.Xác định m và M.b,cho vào 200 ml dung dịch HCL 0,1M một lượng 0,26 gam Zn và 0,28 gam Fe,sau đó thêm tiếp vào dung dịch này kim loại M nói trên cho đến khi thu được dung dịch có chứa 2 muối và chất rắn B có khối lượng lớn khối lượng M đã cho vào là 0,218 gam.Tính khối lượng của M đã sử dụng biết các phản ứng xảy ra hoàn toàn.
Đọc tiếp
a,Cho 100ml dung dịch HCL 0,1M(Khối lượng riêng d=1,05g/mol) hòa tan vừa đủ m gam kim loại M cho ra dung dịch có khối lượng là 105,11 gam.Xác định m và M.
b,cho vào 200 ml dung dịch HCL 0,1M một lượng 0,26 gam Zn và 0,28 gam Fe,sau đó thêm tiếp vào dung dịch này kim loại M nói trên cho đến khi thu được dung dịch có chứa 2 muối và chất rắn B có khối lượng lớn khối lượng M đã cho vào là 0,218 gam.Tính khối lượng của M đã sử dụng biết các phản ứng xảy ra hoàn toàn.
a, \(n_{HCl}=0,1.0,1=0,01\left(mol\right)\)
\(m_{ddHCl}=100.1,05=105\left(g\right)\)
BTNT H, có: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,005\left(mol\right)\)
Theo ĐLBT KL, có: mM + m dd HCl = m dd sau pư + mH2
⇒ mM = 105,11 + 0,005.2 - 105 = 0,12 (g) = m
Giả sử M có hóa trị n.
BT e, có: n.nM = 2nH2 \(\Rightarrow n_M=\dfrac{2n_{H_2}}{n}=\dfrac{0,01}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{0,12}{\dfrac{0,01}{n}}=12n\left(g/mol\right)\)
Với n = 2, MM = 24 (g/mol) là thỏa mãn.
Vậy: M là Mg.
b, Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{0,26}{65}=0,004\left(mol\right)\\n_{Fe}=\dfrac{0,28}{56}=0,005\left(mol\right)\end{matrix}\right.\)
\(n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,004_____0,008__0,004 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,005____0,01____0,005 (mol)
⇒ nHCl (dư) = 0,02 - 0,008 - 0,01 = 0,002 (mol)
Sau pư trong dd còn: \(\left\{{}\begin{matrix}ZnCl_2:0,004\left(mol\right)\\FeCl_2:0,005\left(mol\right)\\HCl:0,002\left(mol\right)\end{matrix}\right.\)
- Cho Mg vào đến khi thu dd có chứa 2 muối (MgCl2 và ZnCl2):
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
__0,001______0,002 (mol)
\(Mg+FeCl_2\rightarrow MgCl_2+Fe\)
0,005_____0,005___________0,005 (mol)
\(Mg+ZnCl_2\rightarrow MgCl_2+Zn\)
x_________x_______________x (mol)
B gồm: 0,005 (mol) Fe và x (mol) Zn
Mà: mB - mMg = 0,218
⇒ 0,005.56 + 65x - (0,001 + 0,005 + x).24 = 0,218
⇒ x = 0,002 (mol)
⇒ mMg pư = (0,001 + 0,005 + 0,002).24 = 0,192 (g)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây ? (Biết hoá trị của kim loại trong khoảng từ I đến III)
A. Ca ; B. Mg ; C. Al ; D. Fe.
Đáp án C.
Gọi nguyên tử khối của kim loại M cũng là M, có hóa trị là x, ta có:
n M = 18/M (mol); n HCl = 0,8 x 2,5 = 2 mol
Phương trình hóa học
2M + 2xHCl → 2 MCl x + x H 2
Có: 18/M x 2x = 4 → M = 9x
Xét bảng sau
| X | I | II | III |
| M | 9 | 18 | 27 |
Chỉ có kim loại hóa trị III ứng với M = 27 là phù hợp, kim loại M là nhôm (Al)
Đúng 0
Bình luận (0)
Câu 1. Viết PTHH biểu diễn chuyển đổi hóa học sau:
Ferightarrow FeCl_3rightarrow Feleft(OHright)_3rightarrow Fe_2O_3rightarrow Fe
Câu 2. Cho m gam kim loại M hòa tan hoàn toàn trong 100 ml dd HCl 0,1M (D 1,05 g/ml) được dd X có khối lượng là 105,11 gam. Xác định m và M, biết rằng kim loại có hóa trị từ I đến III
Câu 3. Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối của kim loại có hóa trị I. Hãy xác định tên của kim loại.
Help me :((((( Mình cần gấp!!!!!!
Đọc tiếp
Câu 1. Viết PTHH biểu diễn chuyển đổi hóa học sau:
\(Fe\rightarrow FeCl_3\rightarrow Fe\left(OH\right)_3\rightarrow Fe_2O_3\rightarrow Fe\)
Câu 2. Cho m gam kim loại M hòa tan hoàn toàn trong 100 ml dd HCl 0,1M (D = 1,05 g/ml) được dd X có khối lượng là 105,11 gam. Xác định m và M, biết rằng kim loại có hóa trị từ I đến III
Câu 3. Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối của kim loại có hóa trị I. Hãy xác định tên của kim loại.
Help me :((((( Mình cần gấp!!!!!!
Câu 1.
(1) \(2Fe+3Cl_3\underrightarrow{t^o}2FeCl_3\)
(2) \(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
(3) \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
(4) \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Câu 2.
Khối lượng dd HCl là:
\(m_{dd}=V\cdot D=100\cdot1,05=105\left(g\right)\)
\(\rightarrow n_{HCl}=0,1\cdot0,1=0,01\left(mol\right)\)
Gọi hóa trị của kim loại M là x
PTHH:
2M + 2xHCl ---> 2MClx + xH2
\(\frac{0,01}{x}\)__ 0,01______\(\frac{0,01}{x}\)___\(\frac{0,01}{2}\) (mol)
Áp dụng định luật bảo toàn khối lượng:
m + mHCl = mmuối + m\(H_2\)
\(m=105,11+\frac{0,01}{2}\cdot2-105=0,12\left(g\right)\)
Theo pt: \(n_M=\frac{0,01}{2}\rightarrow\frac{0,01}{x}\cdot M=0,12\rightarrow M=12x\)
Kẻ bảng:
| n |
1_______2________3 |
| M |
12_____24_______36 (loại)_(nhận)____(loại) |
Vậy kim loại M là Mg
Câu 3.
Gọi kí hiệu và nguyên tử khối của kim loại là M.
PTHH:
2M + Cl2 -------> 2MCl
2M (g)________2(M + 35,5) (g)
9,2 (g)_________23,4 (g)
\(9,2\cdot2\left(M+35,5\right)=2M+23,4\)
\(\Leftrightarrow653,2=28,4M\)
\(\Leftrightarrow M=23\)
Vậy kim loại M là Na
Đúng 0
Bình luận (1)
Câu 1:
PTHH: 2Fe + 3Cl2 \(\underrightarrow{t^o}\) 2FeCl3
FeCl3 + 3NaOH \(\rightarrow\) Fe(OH)3\(\downarrow\) + 3NaCl
2Fe(OH)3 \(\underrightarrow{t^o}\) Fe2O3 + 3H2O
Fe2O3 + 3CO \(\underrightarrow{t^o}\) 2Fe + 3CO2\(\uparrow\)
Đúng 0
Bình luận (0)
Câu 2:
PTHH:2M + 2nHCl \(\rightarrow\) 2MCln +nH2\(\uparrow\)
mdd HCl = 1,05.100 = 105 (g)
nHCl = \(\frac{100.0,1}{1000}=0,01\left(mol\right)\)
Theo PT: n\(H_2\) = \(\frac{1}{2}n_{HCl}=\frac{1}{2}.0,01=0,005\left(mol\right)\)
=> m\(H_2\) = 0,005.2 = 0,01 (g)
Áp dụng ĐLBTKL ta có:
mM + mdd HCl = mdd X + m\(H_2\)
=> mM =(105,11 + 0,01)- 105 = 0,12 (g)
Theo PT: nM = \(\frac{1}{n}n_{HCl}=\frac{1}{n}.0,01=\frac{0,01}{n}\left(mol\right)\)
=> MM = \(\frac{0,12}{\frac{0,01}{n}}=12n\left(\frac{g}{mol}\right)\)
Ta có bảng sau:
| n | 1 | 2 | 3 |
| M | 12 | 24 | 36 |
| loại | Mg | loại |
Vậy M là magie (Mg)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III). A. Ca B. Mg C. Al D. Fe
Đọc tiếp
Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
A. Ca
B. Mg
C. Al
D. Fe
Nhúng một lá kim loại M (chỉ có hoá trị hai trong hợp chất) có khối lượng 50 gam vào 200 ml dung dịch AgNO3 1M cho đến khi phản ứng xảy ra hoàn toàn. Lọc dung dịch, đem cô cạn thu được 18,8 gam muối khan. Kim loại M là A. Mg B. Cu C. Zn D. Fe
Đọc tiếp
Nhúng một lá kim loại M (chỉ có hoá trị hai trong hợp chất) có khối lượng 50 gam vào 200 ml dung dịch AgNO3 1M cho đến khi phản ứng xảy ra hoàn toàn. Lọc dung dịch, đem cô cạn thu được 18,8 gam muối khan. Kim loại M là
A. Mg
B. Cu
C. Zn
D. Fe
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H 2 S O 4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
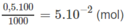
Số mol NaOH trong 33,4 ml nồng độ 1M :
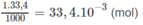
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 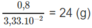
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Đúng 0
Bình luận (0)
Câu 7. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H2SO4 0,3M. Để trung hoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M?
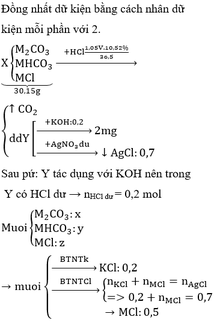
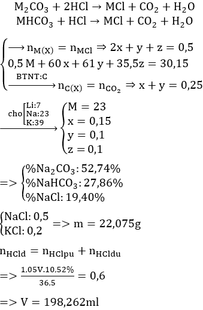
Hỗn hợp X gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Hòa tan hoàn toàn 30,15 gam hỗn hợp X trong V ml dung dịch HCl 10,52% (D 1,05g/ml) thu được dung dịch Y và 5,6 lít CO2 (đktc). Chia Y thành 2 phần bằng nhau. – Phần 1: tác dụng vừa đủ với 100 ml dung dịch KOH 1M thu được m gam muối. – Phần 2: tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 50,225 gam kết tủa. a. Xác định tên kim loại M. b. Tính thành phần phần trăm theo khối lượng của từng chất trong hỗn hợp X. c. Tính V và m.
Đọc tiếp
Hỗn hợp X gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Hòa tan hoàn toàn 30,15 gam hỗn hợp X trong V ml dung dịch HCl 10,52% (D = 1,05g/ml) thu được dung dịch Y và 5,6 lít CO2 (đktc). Chia Y thành 2 phần bằng nhau.
– Phần 1: tác dụng vừa đủ với 100 ml dung dịch KOH 1M thu được m gam muối.
– Phần 2: tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 50,225 gam kết tủa.
a. Xác định tên kim loại M.
b. Tính thành phần phần trăm theo khối lượng của từng chất trong hỗn hợp X.
c. Tính V và m.