
Những câu hỏi liên quan
Một bình chứa hỗn hợp khí X gồm 1,12 lít khí oxi và 2,24 lít khí cacbon đioxit ở đktc. Tổng số mol các khí trong hỗn hợp khí X là:
A. 0,25
B. 0,5
C. 0,15
D. 0,20
Nung m gam hỗn hợp X gồm KClO3 và KMnO4 thu được chất rắn Y và O2. Biết KClO3 phân hủy hoàn toàn, còn KMnO4 chỉ bị phân hủy một phần. Trong Y có 0,894 gam KCl chiếm 8,132% theo khối lượng. Trộn lượng O2 ở trên với không khí theo tỉ lệ thể tích VO2 : Vkk 1 : 3 trong một bình kín ta thu được hỗn hợp khí Z. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon, phản ứng hoàn toàn, thu được hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22,92% thể tích. Biết không khí chứa 20% thể tích oxi...
Đọc tiếp
Nung m gam hỗn hợp X gồm KClO3 và KMnO4 thu được chất rắn Y và O2. Biết KClO3 phân hủy hoàn toàn, còn KMnO4 chỉ bị phân hủy một phần. Trong Y có 0,894 gam KCl chiếm 8,132% theo khối lượng. Trộn lượng O2 ở trên với không khí theo tỉ lệ thể tích VO2 : Vkk = 1 : 3 trong một bình kín ta thu được hỗn hợp khí Z. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon, phản ứng hoàn toàn, thu được hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22,92% thể tích. Biết không khí chứa 20% thể tích oxi, còn lại là. Giá trị m (gam) là
A. 12,59
B. 12,53
C. 12,70
D. 12,91
Đáp án B
Từ mKCl = 0,894g => mY = 10,994g
Đặt nO2 tạo ra = x => nkk = 3x có nO2 = 0,75x và nN2 = 2,25x (mol)
, nCO2 = nC = 0,044 mol => nO2 dư = (x + 0,75x) – 0,044 (mol)
=> nT = nCO2.100/22,92 = nO2 dư + nN2 + nCO2
=> 1,75x – 0,044 + 2,25x + 0,044 = 0,192
=> x = 0,048 mol
=> m = mY + mO2 tạo ra = 12,53g
=>B
Đúng 0
Bình luận (1)
Đốt cháy hoàn toàn 7,68 g hỗn hợp rắn A gồm Cacbon và lưu huỳnh trong khí oxi thu được 9,856 lít hỗn hợp khí gồm lưu huỳnh đioxit và Cacbon oxit .tính phần trăm khối lượng của mỗi chất rắn trong hỗn hợp A
Gọi số mol C, S là a, b
=> 12a + 32b = 7,68
PTHH: C + O2 --to--> CO2
_____a--------------->a
S + O2 --to--> SO2
b--------------->b
=> a + b = \(\dfrac{9,856}{22,4}=0,44\)
=> a = 0,32; b = 0,12
=> \(\left\{{}\begin{matrix}\%C=\dfrac{0,32.12}{7,68}.100\%=50\%\\\%S=\dfrac{0,12.32}{7,68}.100\%=50\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Nung m gam hỗn hợp A gồm KMnO4và KClO3 thu được chất rắn B và khí oxi, lúc đó KClO3 bị phân hủy hoàn toàn còn KMnO4 bị phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132 % khối lượng. Trộn lượng oxi ở trên với không khí theo tỷ lệ thể tích 1: 3 trong một bình kín thu được hỗn hợp khí X. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí Y gồm 3 khí trong đó CO2 chiếm 22,92% thể tích. Tính m. (Coi không khí gồm 20% thể tích là oxi còn lại là nitơ).
Đọc tiếp
Nung m gam hỗn hợp A gồm KMnO4và KClO3 thu được chất rắn B và khí oxi, lúc đó KClO3 bị phân hủy hoàn toàn còn KMnO4 bị phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132 % khối lượng. Trộn lượng oxi ở trên với không khí theo tỷ lệ thể tích 1: 3 trong một bình kín thu được hỗn hợp khí X. Cho vào bình 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí Y gồm 3 khí trong đó CO2 chiếm 22,92% thể tích. Tính m. (Coi không khí gồm 20% thể tích là oxi còn lại là nitơ).
Gọi a , b là số mol của KCLO3 và KMnO4
T/h 1 : Y có CO2 , N2 , O2 dư
KCLO3 ----> KCL + 3/2 O2
2 KMnO4 -----> K2MnO4 + MnO2 + O2
Gọi nO2 = x => nO2 / kk = 3x * 0,2 = 0.6x , nN2 = 3x*0.2 = 2.4x
hh khí gồm nO2 = 1.6x ; nN2 = 2.4x
Pt
C + O2 -----> CO2
nCO2 = nC = 0.528/12 = 0.044
hh khí gồm : nCO2 = 0.044 ; nO2 = 1.6x - 0.044 ; nN2 = 2.4x
=> 0.044 + 1.6x - 0.044 + 2.4x = 0.044*100 / 22.92
<=> x = 0.048
=> mmh đầu = mY + MO2 = 0.894*100 / 8.132 + 0.048* 32 = 12.53
T/h 2 : Y có CO , CO2 ; N2
Bảo toàn C : nCO + nCO2 = nC = 0.044 => nCO = 0.044 - nCO2
Bảo toàn O : 0.5*nCO + nCO2 = nO2 = 1.6a
Thay * vào đc : 0.5*( 0.044 - nCO2 ) + nCO2 = 1.6a => nCO2 = 3.2a - 0.044
Tổng mol hh : nCO + nCO2 + nN2 = 0.044 + 2.4a
=> ( 3.2a - 0.044 ) / ( 0.044 + 2.4a ) = 22.92/100
a \(\approx\)0.02
=> m = m rắn + mO2 = 0.894 *100/8.132 + 0.02 * 32 = 11.646 ( g )
Trong một bình kín có chứa hỗn hợp khí X gồm khí cacbon oxit(CO) và cacbon đioxit (CO2), khi phân tích định lượng hỗn hợp khí X người ta thu được kết quả 2,4g cacbon và 3,584 lít khí oxi(ở đktc)
a) Tính số mol mỗi chất trong hỗn hợp X
b) Tính thành phần phần trăm theo thể tích của hai khí trong hỗn hợp X
a)
Gọi số mol CO là x và CO2 là y
Phân tích X thu được 2,4 gam cacbon và 3,584 lít khí O2.
Ta có: nC=2,4/12=0,2 mol; nO2=3,584/22,4=0,16 mol
\(\rightarrow\) nO=2nO2=0,32 mol.
CO có 1 C và 1O; CO2 có 1 C và 2 O.
\(\rightarrow\) x+y=0,2; x+2y=0,32
Giải được x=0,08; y=0,12
b)Vì cùng điều kiện nên % số mol bằng % thể tích
\(\rightarrow\)%CO=0,08/(0,08+0,12)=40% \(\rightarrow\) %CO2=60%
a) \(n_{CO}=\frac{2,4}{28}=0,086\left(mol\right)\)
n \(_{O2}=\frac{3,584}{22,4}=0,16\left(mol\right)\)
b) Ta có
V\(_{CO}=0,086.22,4=1,93\left(l\right)\)
\(\sum V=1,93+3,584=5,514\left(l\right)\)
%VCO=\(\frac{1,93}{5,514}.100\%=35\%\)
%VCO2=100-35=65%
Sao máy bị lag hay sao ý nhỉ
Hiện lên 1 câu chả lời mà lướt xuống k thấy một câu nào hết
Xem thêm câu trả lời
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic
C
O
2
và khí oxi
O
2
dư.Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 0,3.
10
23
phân tử
C
O
2
và...
Đọc tiếp
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic C O 2 và khí oxi O 2 dư.
Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 0,3. 10 23 phân tử C O 2 và 0,9. 10 23 phân tử O 2 .
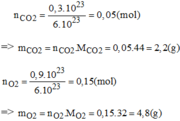
Thành phần % theo khối lượng:
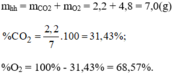
Thành phần % về thể tích:
Đúng 1
Bình luận (0)
Trong công nghiệp người ta dùng than khử oxi của nước trong lò khí than để thu được 11.2 lít hỗn hợp khí X gồm hidro, cacbon oxit, cacbon dioxit(đktc)
1. Viết PTHH xảy ra
2. Lấy lượng khí X thu được ở trên tác dụng với đồng(II) oxit (dư) được 25.6g đồng kim loại. Tính % thể tích hỗn hợp X và tỉ khối của X so với oxi
1)
\(C+H_2O\underrightarrow{t^O}CO+H_2\) (1)
\(C+2H_2O\underrightarrow{t^o}CO_2+2H_2\) (2)
2)
Gọi số mol CO, CO2 là a, b (mol)
\(n_{H_2\left(1\right)}=n_{CO}=a\left(mol\right)\)
\(n_{H_2\left(2\right)}=2b\left(mol\right)\)
=> \(n_{H_2}=a+2b\left(mol\right)\)
=> a + b + (a+2b) = \(\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
=> 2a + 3b = 0,5
PTHH: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(CuO+CO\underrightarrow{t^o}Cu+CO_2\)
=> \(n_{H_2}+n_{CO}=n_{Cu}=\dfrac{25,6}{64}=0,4\)
=> (a + 2b) + a = 0,4
=> 2a + 2b = 0,4
=> a = 0,1 ; b = 0,1
=> X chứa \(\left\{{}\begin{matrix}CO:0,1\left(mol\right)\\CO_2:0,1\left(mol\right)\\H_2:0,3\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,1}{0,5}.100\%=20\%\\\%V_{CO_2}=\dfrac{0,1}{0,5}.100\%=20\%\\\%V_{H_2}=\dfrac{0,3}{0,5}.100\%=60\%\end{matrix}\right.\)
\(\overline{M}_X=\dfrac{0,1.28+0,1.44+0,3.2}{0,5}=15,6\left(g/mol\right)\)
=> \(d_{X/O_2}=\dfrac{15,6}{32}=0,4875\)
Đúng 3
Bình luận (8)
Trong công nghiệp người ta dùng than khử oxi của nước trong lò khí than để thu được 11.2 lít hỗn hợp khí X gồm hidro, cacbon oxit, cacbon dioxit(đktc)
1. Viết PTHH xảy ra
2. Lấy lượng khí X thu được ở trên tác dụng với đồng(II) oxit (dư) được 25.6g đồng kim loại. Tính % thể tích hỗn hợp X và tỉ khối của X so với oxi
1. C + H2O \(\underrightarrow{t^o}\) CO + H2
C + 2H2O \(\underrightarrow{t^o}\) CO2 + 2H2.
2. Lượng Cu thu được là 0,4 mol, suy ra lượng đồng (II) oxit phản ứng là 0,4 mol. Lượng nguyên tử oxi phản ứng là 0,4 mol.
Suy ra, tổng lượng CO và H2 trong X là 0,4 mol. Lượng khí X là 0,5 mol. Suy ra, số mol CO2 là 0,1 mol.
Gọi a mol và b mol lần lượt là số mol của CO và H2 có trong X.
Lượng C và H2O ban đầu lần lượt là (0,1+a) mol và b mol.
BTKL: 12(0,1+a)+18b=28a+2b+44.0,1 (1)
a+b=0,4 (2).
Từ (1) và (2), suy ra a=0,1 và b=0,3.
Tỉ lệ phần trăm thể tích các khí có trong X:
%VCO=0,1/0,5=20%, %\(V_{H_2}\)=0,3/0,5=60%, %\(V_{CO_2}\)=20%.
Phân tử khối trung bình của X là (28.0,1+2.0,3+44.0,1)/0,5=7,6.
Tỉ khối của X so với oxi là dX/O=7,6/16=0,475.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic
C
O
2
và khí oxi
O
2
dư.Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 4g khí cacbonic và 16g khí oxi.
Đọc tiếp
Đốt cháy hoàn toàn cacbon bằng một lượng khí oxi dư, người ta thu được hỗn hợp khí gồm có khí cacbonic C O 2 và khí oxi O 2 dư.
Hãy xác định phần trăm theo khối lượng và thành phần phần trăm theo thể tích của khí oxi trong mỗi hỗn hợp sau: 4g khí cacbonic và 16g khí oxi.
Thành phần theo khối lượng:
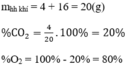
Thành phần phần trăm theo thể tích:

Đúng 0
Bình luận (0)

















